承接上文对溶瘤腺病毒、疱疹病毒和溶瘤麻疹病毒临床阶段所面临的挑战分析,本文将继续对三种不同类别的溶瘤病毒进行剖析。(临床试验中的溶瘤病毒产品解读)
细小病毒H1-PV
啮齿源细小病毒,特别是H1-PV病毒,其本身的稳定性、安全性、跨膜能力和血清型多样性等特点对抗肿瘤药物的研发很有吸引力,其中的一部分特性也同时影响了H1-PV临床级别的病毒生产、纯化和质量控制流程。
首先,H1-PV的自然感染能力较低,与人类疾病的联系较少,有助于保证相关操作人员的安全。此外,细小病毒具有耐高温性,在较为极端的pH环境中也较为稳定,这些特性减少了对相关操作的环境要求。在这些特性以外,病毒制备和生产过程中的具体步骤也同时依赖于H1-PV的物理、化学和生物学特性,包括:
1.病毒的物理结构,基因组结构较为紧凑,使得在纯化和灭菌过程中的过滤步骤较容易实现;
2.成熟的H1-PV可以在脂类溶剂中较为稳定地存在,有助于病毒的纯化和释放过程;
3.实心和空壳的H1-PV的密度区分较为明显,使得其可以通过梯度离心的方式分离浓缩;
4.相较于其他病毒,细小病毒较能承受伽马射线灭活过程;
5.人源细胞可用于高效的H1-PV生产,从而避免了微生物和免疫原性动物蛋白的污染风险;
6.可适用于悬浮培养工艺,有助于工艺放大和产量提高;
当前的H1-PV的批次生产虽然已经符合了有关标准,但是仍存在提高的空间。其中,可以通过对生产用细胞系和生产工艺进行选择和调试,使得大规模生产在无血清条件下得到优化。通过密度离心的方式分离较大的病毒目前较为困难,色谱提纯的流程设计和开发有助于缩短细小病毒提纯所需时间。这些因素都有助于提高临床样品H1-PV的感染能力。
呼肠孤病毒
呼肠孤病毒是一种无包膜的双链DNA病毒,较易于在肿瘤细胞中复制,并通过激活Ras信号通路的方式来裂解肿瘤细胞。这种选择性的细胞裂解是通过抑制dsDNA激活的蛋白激酶的自身磷酸化,使得细胞自身的抗病毒机制失活,从而达到裂解的目的。有研究课题组已经证明呼肠孤病毒诱导的肿瘤细胞裂解刺激了由先天免疫激活和适应性免疫反应组成的有效的抗肿瘤免疫反应。
在溶瘤呼肠孤病毒的生产开发过程中,曾面临过的最大挑战是寻找一种适合的无动物源细胞培养基,以用于早期的工艺开发。这种培养基是用于优化HEK293细胞的悬浮培养,而不是直接地用于优化病毒的生产。但是该培养基的局限在于其本身不支持细胞生长超过2x106cell/mL。由于其中含有酚红,干扰了阴离子交换的提纯步骤,累积的氨也阻碍了呼肠孤病毒的脱壳和反应器中病毒的产量。来自加拿大的OncolyticsBiotech公司与第三方合作开发了一种优化型培养基,以用于呼肠孤病毒生产的优化,最大程度规避上述问题。
痘苗病毒
痘苗病毒是一种有包膜的双链DNA病毒,基因组较大,在人类血清中较为稳定。人们对天花疫苗200年以上的发展研究提供了大量有关痘苗病毒安全性的数据,使得痘苗病毒作为一种溶瘤病毒的可能性及发展方向充满吸引力。此外,痘苗病毒可以容纳并表达超过50kb的治疗性目的基因,并且通过研究,人们已经知悉了多种在人和啮齿类动物体内痘苗病毒的抗肿瘤机制。
尽管取得了令人欣喜的结果,且某些溶瘤痘苗病毒药物已经进展到了临床III期阶段,溶瘤痘苗病毒的广泛商业化仍然存在着挑战与考验。像其他溶瘤病毒药物平台一样,在大剂量注射试验中,静脉注射之后患者体内需要监控肿瘤内部的病毒浓度。为了达到大剂量生产规模,贴壁式培养肿瘤细胞往往被视作生产痘苗病毒最有效的方式。为了满足法规要求,需要对病毒产品进行广泛测试以确保最终产品中没有致癌性DNA的存在。另外,痘苗病毒与细胞密切相关,需要破碎细胞和酶消化步骤从细胞碎片中释放痘苗病毒,以减少来自宿主细胞的污染源。还需要强调的是,在GMP生产中,需要对拥有较大体积的痘苗病毒进行过滤,且保证无菌操作。使得具有包膜结构的病毒浓缩、稳定的生产工艺策略,才可以更有效地给患者提供溶瘤病毒产品。
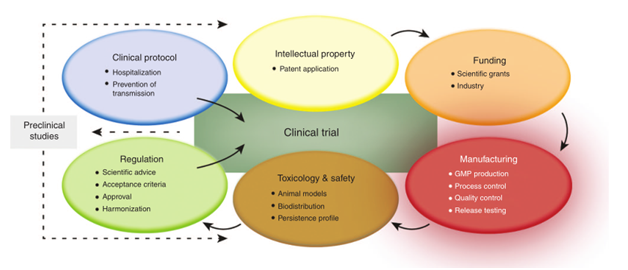

Fig1.溶瘤病毒产品从实验室规模到临床阶段的转化的关键步骤。
(Ungerechts,G.etal.Movingoncolyticvirusesintotheclinic:clinical-gradeproduction,purification,andcharacterizationofdiverseoncolyticviruses.MolecularTherapy-MethodsandClinicalDevelopment3,16018(2016))
结语:溶瘤病毒生产的未来方向
对于不同的溶瘤病毒而言,成熟且易于放大的生产工艺始终是临床治疗级别溶瘤病毒药物的发展方向,应从主细胞库和主毒株库开始,逐步建立稳定的、符合GMP规范的工艺步骤流程。在传统的贴壁培养以外,尝试使用微载体培养和悬浮培养生物反应器为主的工艺,可能在GMP规范下提高病毒滴度。另外需要强调的是,由于病毒本身特性及生产工艺的要求,统一的、标准化的下游纯化工艺可能并不能适用于每一种溶瘤病毒药物。
质量控制一直是GMP生产要求的重要部分,需要对采样、标准规格制定、测试、文件记录和放行流程等具体步骤进行监控保证。在上游开发过程中,选择丰富的溶瘤病毒种类的同时,功能性基因及靶点的选择和改造需要研发人员的不断创新,以突破专利壁垒的限制。此外,全过程无菌的生产工艺应成为发展溶瘤病毒工艺的重要要求及发展方向。
Reference:
1.Cotmore,SFandTattersall,P(2007).Parvoviralhostrangeandcellentrymechanisms.AdvVirusRes70:183–232.
2.Strong,JE,Coffey,MC,Tang,D,Sabinin,PandLee,PW(1998).Themolecularbasisofviraloncolysis:usurpationoftheRassignalingpathwaybyreovirus.EMBOJ17:3351–3362.
3.Rajani,K,Parrish,C,Kottke,T,Thompson,J,Zaidi,S,Ilett,Letal.(2016).Combinationtherapywithreovirusandanti-PD-1blockadecontrolstumorgrowththroughinnateandadaptiveimmuneresponses.MolTher24:166–174.
4.Errington,F,Steele,L,Prestwich,R,Harrington,KJ,Pandha,HS,Vidal,Letal.(2008).Reovirusactivateshumandendriticcellstopromoteinnateantitumorimmunity.JImmunol180:6018–6026.
5.Prestwich,RJ,Errington,F,Ilett,EJ,Morgan,RS,Scott,KJ,Kottke,Tetal.(2008).Tumorinfectionbyoncolyticreovirusprimesadaptiveantitumorimmunity.ClinCancerRes14:7358–7366.
6.Kirn,DHandThorne,SH(2009).Targetedandarmedoncolyticpoxviruses:anovelmulti-mechanistictherapeuticclassforcancer.NatRevCancer9:64–71.
7.Kim,JH,Oh,JY,Park,BH,Lee,DE,Kim,JS,Park,HEetal.(2006).SystemicarmedoncolyticandimmunologictherapyforcancerwithJX-594,atargetedpoxvirusexpressingGM-CSF.MolTher14:361–370.
8.Heo,J,Reid,T,Ruo,L,Breitbach,CJ,Rose,S,Bloomston,Metal.(2013).Randomizeddose-findingclinicaltrialofoncolyticimmunotherapeuticvacciniaJX-594inlivercancer.NatMed19:329–336.
9.Breitbach,CJ,Burke,J,Jonker,D,Stephenson,J,Haas,AR,Chow,LQetal.(2011).Intravenousdeliveryofamulti-mechanisticcancer-targetedoncolyticpoxvirusinhumans.Nature477:99–102.
10.Kirn,DH,Wang,Y,Liang,W,Contag,CHandThorne,SH(2008).Enhancingpoxvirusoncolyticeffectsthroughincreasedspreadandimmuneevasion.CancerRes68:2071–2075.