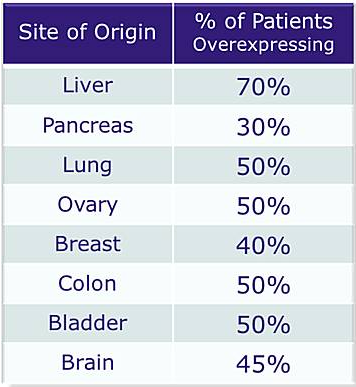
天然免疫对肿瘤的免疫监视至关重要,如自然杀伤细胞可以不依赖抗体和补体直接杀伤肿瘤细胞【1】,巨噬细胞负责发现肿瘤细胞并将肿瘤抗原递呈给并激活细胞毒性T细胞(CD8+T细胞)【2】,后者特异性识别、杀灭肿瘤细胞。肿瘤细胞则进化出了一系列逃逸机制,以躲避宿主免疫系统的攻击【3】。其中以上调免疫检查点分子的表达最为著名,如肿瘤细胞高表达PD-1和/或CTLA-4抑制T细胞的活化。PD-1和CTLA-4抗体的临床应用是当今最令人激动的突破和国际公认最有前景的癌症治愈手段,获得了2018年的诺贝尔生理学或医学奖【4-10】。然而,免疫检查点抑制剂只对大约20%的肿瘤患者有效【11-13】,如何提高肿瘤患者对免疫治疗的反应性是亟待解决的关键问题。近期一系列的研究发现,肿瘤组织中Mφ和DC内感受胞质DNA的cGAS-STING通路可以被肿瘤细胞来源的DNA激活,促进这些抗原递呈细胞的成熟,进而将肿瘤特异性抗原递呈给T细胞,对于复苏机体的抗肿瘤免疫反应起到至关重要的作用【14-20】。目前全球许多科研机构和制药公司纷纷投入巨资,寻找cGAS-STING通路的激动剂【21-25】。然而目前已知的这些激动剂都制备复杂,成本高昂,而且无法有效进入细胞,因此治疗效果不理想【26,27】。
北京大学生科院蒋争凡实验室是世界上同期发现STING分子与功能的实验室之一(命名为ERIS,武汉大学舒红兵实验室命名其为MITA)【28-31】,近年来在该领域取得了一系列成果。2018年,蒋争凡实验室发表在Immunity的工作发现锰离子在激活cGAS-STING通路中的重要作用:病毒感染细胞导致线粒体、高尔基体等贮锰细胞器中的Mn2+释放到胞质及胞外。胞质中显著升高的Mn2+浓度对cGAS-STING通路具有双重激活的作用:Mn2+能够上万倍地提升cGAS对于DNA的检测灵敏度并促进其合成第二信使cGAMP;Mn2+上百倍地增强STING与cGAMP的结合能力。这样,释放到胞质的Mn2+使得细胞的cGAS-STING通路处于超活化的状态,极大地提升其对胞质DNA的响应能力,甚至使其在原本不具激活能力的DNA水平下也能够被激活。而当小鼠缺乏锰元素时,其抵抗DNA病毒的能力受到显著抑制(详见BioArt报道:蒋争凡组Immunity揭示锰离子抵御DNA病毒入侵的新机制)【32】。2020年8月18日,蒋争凡实验室与苏晓东实验室合作发表在CellReports的工作进一步阐释了Mn2+激活cGAS的分子机制,发现Mn2+还可以直接激活cGAS,而且Mn2+催化与Mg2++dsDNA催化cGAS合成cGAMP的过程显著不同【33】。Mn2+-cGAS结合导致cGAS构象发生类似于DNA-cGAS结合的变化,但催化中心的结构明显不同,导致cGAMP在cGAS酶催化中心的合成过程也发生很大变化。这个研究进一步证明Mn2+DNA以外的第二个cGAS激活剂。然而,锰元素/锰离子在抗肿瘤免疫中的作用尚不清楚。
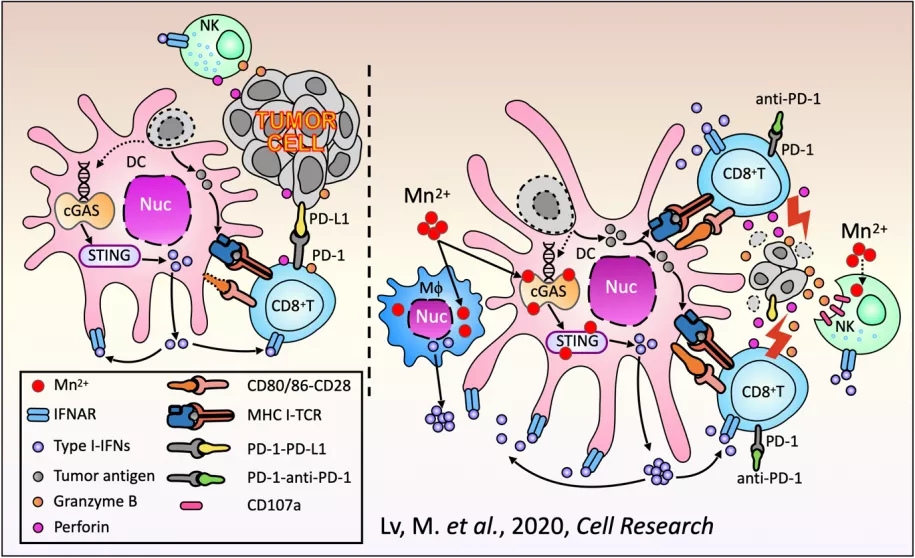
2020年8月24日,蒋争凡实验室与解放军总医院第一医学中心生物治疗科韩为东团队合作在CellResearch上以ResearchArticle的形式在线发表了肿瘤免疫领域的最新成果“ManganeseiscriticalforantitumorimmuneresponsesviacGAS-STINGandimprovestheefficacyofclinicalimmunotherapy”。在本研究中【34】,蒋争凡实验室首先发现缺锰小鼠体内的肿瘤细胞生长显著加快、肿瘤肺转移显著增多,说明在生理条件下,作为必需微量元素的锰在肿瘤免疫中也发挥必不可少的作用。


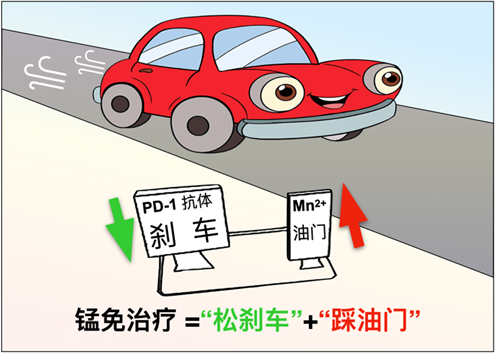
外源添加Mn2+则可有效激活人或小鼠细胞的cGAS-STING通路,显著促进宿主抗原递呈细胞如DC和Mφ对于肿瘤抗原的递呈能力,促进细胞毒性T细胞在肿瘤组织内的浸润,并增强这些细胞对肿瘤细胞的特异性杀伤。另外,Mn2+可以促进记忆性T细胞的存活与增殖。另一方面,Mn2+也能显著增强NK细胞的肿瘤杀伤能力,促进宿主的肿瘤免疫监视作用。Mn2+的瘤内注射不仅使绝大多数荷瘤小鼠被注射的肿瘤完全消除,而且可强烈抑制对侧身体肿瘤的生长。这些结果都表明Mn2+是一个优良的肿瘤免疫激活剂,增强机体对肿瘤细胞的免疫监视和免疫清除。鉴于此,他们尝试将Mn2+和PD-1抗体联合使用,发现“锰免疗法”在多种肿瘤模型中都可以显著增强PD-1抗体的肿瘤治疗效果,而且可显著减少PD-1抗体的使用量。如果把肿瘤的免疫治疗看成是一辆行驶的汽车,那么PD-1抗体的使用相当于解除了汽车的刹车,而cGAS-STING激活剂(如Mn2+)的使用则像是给发动机加油。只有二者同时使用,才能使肿瘤免疫治疗这辆汽车全速行驶。上述结果暗示Mn2+可能有着巨大的临床转化前景。
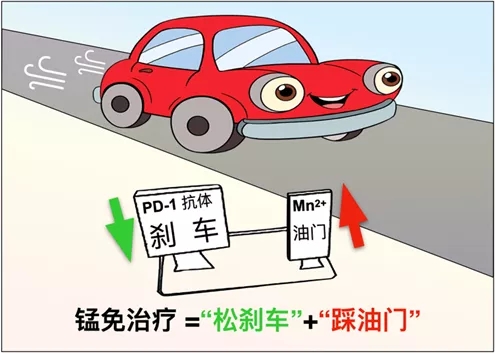
韩为东团队已完成的“锰免疗法”I期临床结果显示,针对多种复发难治或进展期上皮源肿瘤,Mn2+联合PD-1抑制剂方案获得了令人印象深刻的显著疗效(客观缓解率达45.5%,疾病控制率达90.9%)。值得注意的是,5例PD-1抑制剂耐药患者经“锰免疗法”治疗后均获得了较好的疾病控制,其中3例达到部分缓解,提示了Mn2+对免疫治疗耐药的调控作用。以铂类耐药复发难治性卵巢癌为例,8例入组患者中6例获得部分缓解,并且6例伴有冰冻盆腔的患者均出现松解。此外,该方案还显示出了良好的临床安全性,在中位11.8个月随访中未观察到明显神经蓄积毒性,而促炎因子释放等导致的免疫治疗相关毒性经特异性抗体治疗可以有效控制、缓解。I期临床试验初步证实了“锰免疗法”在复发难治及进展期肿瘤中的临床安全性和有效性,目前该方案在单病种中II期临床正在有序推进。临床研究的结果进一步表明:免疫检查点抑制剂的“松刹车”作用是比较有限的,若是同时通过“踩油门”,促进天然免疫系统对肿瘤细胞的免疫监视,或者将冷肿瘤转变为热肿瘤,则可显著提升肿瘤患者对于治疗的响应率。
综上,本研究证明了锰元素/锰离子在抗肿瘤免疫中发挥至关重要的作用,为肿瘤免疫治疗开创了新的思路和治疗方案,并显示出巨大的临床应用前景。由于锰的储备量巨大,二价锰溶液的制备简单、成本低廉,它的运输、储存非常方便,这些优点使得“锰免疗法”容易得到应用并可显著降低肿瘤医治成本,造福于患者和国家。
据悉,北京大学生科院PTN项目已毕业的吕梦泽博士、解放军总医院第一医学中心生物治疗科陈美霞主治医生为论文的共同第一作者;生科院/北大--清华生命科学联合中心的蒋争凡教授及解放军总医院第一医学中心生物治疗科的韩为东教授,梅倩副研究员为共同通讯作者。
原文链接:
https://www.nature.com/articles/s45-4
参考文献
1.Kumar,V.McNerney,M.E.Anewself:MHC-class-I-independentnatural-killer-cellself-tolerance.NatRevImmunol5,363-374,doi:10.1038/nri1603(2005).
2.Trombetta,E.S.Mellman,I.Cellbiologyofantigenprocessinginvitroandinvivo.AnnuRevImmunol23,975-1028,doi:10.1146/annurev.immunol.22.012703.104538(2005).
3.O'Donnell,J.S.,Teng,M.W.L.Smyth,M.J.CancerimmunoeditingandresistancetoTcell-basedimmunotherapy.NatRevClinOncol16,151-167,doi:10.1038/s4-8(2019).
4.Brunet,J.F.etal.Anewmemberoftheimmunoglobulinsuperfamily--CTLA-4.Nature328,267-270,doi:10.1038/328267a0(1987).
5.Walunas,T.L.etal.CTLA-4canfunctionasanegativeregulatorofTcellactivation.Immunity1,405-413,doi:10.(94)90071-x(1994).
6.Waterhouse,P.etal.LymphoproliferativedisorderswithearlylethalityinmicedeficientinCtla-4.Science270,985-988,doi:10.1126/science.(1995).
7.Tivol,E.A.etal.LossofCTLA-4leadstomassivelymphoproliferationandfatalmultiorgantissuedestruction,revealingacriticalnegativeregulatoryroleofCTLA-4.Immunity3,541-547,doi:10.(95)90125-6(1995).
8.Leach,D.R.,Krummel,M.F.Allison,J.P.EnhancementofantitumorimmunitybyCTLA-4blockade.Science271,1734-1736,doi:10.1126/science.(1996).
9.Nishimura,H.,Nose,M.,Hiai,H.,Minato,N.Honjo,T.Developmentoflupus-likeautoimmunediseasesbydisruptionofthePD-1geneencodinganITIMmotif-carryingimmunoreceptor.Immunity11,141-151,doi:10.1016/s1074-7613(00)80089-8(1999).
10Ishida,Y.,Agata,Y.,Shibahara,K.Honjo,T.InducedexpressionofPD-1,anovelmemberoftheimmunoglobulingenesuperfamily,uponprogrammedcelldeath.EMBOJ11,3887-3895(1992).
11Topalian,S.L.,Drake,C.G.Pardoll,D.M.Immunecheckpointblockade:acommondenominatorapproachtocancertherapy.CancerCell27,450-461,doi:10.1016/j.ccell.2015.03.001(2015).
12Huang,A.C.etal.T-cellinvigorationtotumourburdenratioassociatedwithanti-PD-1response.Nature545,60-65,doi:10.1038/nature22079(2017).
13Ribas,A.etal.AssociationofPembrolizumabWithTumorResponseandSurvivalAmongPatientsWithAdvancedMelanoma.JAMA315,1600-1609,doi:10.1001/jama.2016.4059(2016).
14Deng,L.etal.STING-DependentCytosolicDNASensingPromotesRadiation-InducedTypeIInterferon-DependentAntitumorImmunityinImmunogenicTumors.Immunity41,843-852,doi:10.1016/j.immuni.2014.10.019(2014).
15Woo,S.R.etal.STING-dependentcytosolicDNAsensingmediatesinnateimmunerecognitionofimmunogenictumors.Immunity41,830-842,doi:10.1016/j.immuni.2014.10.017(2014).
16Woo,S.R.,Corrales,L.Gajewski,T.F.TheSTINGpathwayandtheTcell-inflamedtumormicroenvironment.TrendsImmunol36,250-256,doi:10.1016/j.it.2015.02.003(2015).
17Chen,Q.,Sun,L.Chen,Z.J.RegulationandfunctionofthecGAS-STINGpathwayofcytosolicDNAsensing.NatImmunol17,1142-1149,doi:10.1038/ni.3558(2016).
18Wang,H.etal.cGASisessentialfortheantitumoreffectofimmunecheckpointblockade.ProcNatlAcadSciUSA114,1637-1642,doi:10.1073/pnas.1621363114(2017).
19Dunn,G.P.etal.AcriticalfunctionfortypeIinterferonsincancerimmunoediting.NatImmunol6,722-729,doi:10.1038/ni1213(2005).
20Dubensky,T.W.,Jr.Reed,S.G.Adjuvantsforcancervaccines.SeminImmunol22,155-161,doi:10.1016/j.smim.2010.04.007(2010).
21Roberts,Z.J.,Ching,L.M.Vogel,S.N.IFN-beta-dependentinhibitionoftumorgrowthbythevasculardisruptingagent5,6-dimethylxanthenone-4-aceticacid(DMXAA).JInterferonCytokineRes28,133-139,doi:10.1089/jir.2007.0992(2008).
22Conlon,J.etal.Mouse,butnothumanSTING,bindsandsignalsinresponsetothevasculardisruptingagent5,6-dimethylxanthenone-4-aceticacid.JImmunol190,5216-5225,doi:10.4049/jimmunol.1300097(2013).
23Corrales,L.etal.DirectActivationofSTINGintheTumorMicroenvironmentLeadstoPotentandSystemicTumorRegressionandImmunity.CellRep11,1018-1030,doi:10.1016/j.celrep.2015.04.031(2015).
24Demaria,O.etal.STINGactivationoftumorendothelialcellsinitiatesspontaneousandtherapeuticantitumorimmunity.ProcNatlAcadSciUSA112,15408-15413,doi:10.1073/pnas.1512832112(2015).
25Ramanjulu,J.M.etal.DesignofamidobenzimidazoleSTINGreceptoragonistswithsystemicactivity.Nature564,439-443,doi:10.1038/s4-y(2018).
26Lara,P.N.,Jr.etal.RandomizedphaseIIIplacebo-controlledtrialofcarboplatinandpaclitaxelwithorwithoutthevasculardisruptingagentvadimezan(ASA404)inadvancednon-small-celllungcancer.JClinOncol29,2965-2971,doi:10.1200/JCO.2011.35.0660(2011).
27Bhattacharya,N.etal.NormalizingMicrobiota-InducedRetinoicAcidDeficiencyStimulatesProtectiveCD8(+)TCell-MediatedImmunityinColorectalCancer.Immunity45,641-655,doi:10.1016/j.immuni.2016.08.008(2016).
28Ishikawa,H.Barber,G.N.STINGisanendoplasmicreticulumadaptorthatfacilitatesinnateimmunesignalling.Nature455,674-678,doi:10.1038/nature07317(2008).
29Zhong,B.etal.TheadaptorproteinMITAlinksvirus-sensingreceptorstoIRF3transcriptionfactoractivation.Immunity29,538-550,doi:10.1016/j.immuni.2008.09.003(2008).
30Sun,W.etal.ERIS,anendoplasmicreticulumIFNstimulator,activatesinnateimmunesignalingthroughdimerization.ProcNatlAcadSciUSA,doi:10.1073/pnas.0900850106(2009).
31Jin,L.etal.MPYS,anovelmembranetetraspanner,isassociatedwithmajorhistocompatibilitycomplexclassIIandmediatestransductionofapoptoticsignals.MolCellBiol28,5014-5026,doi:10.1128/MCB.00640-08(2008).
32Wang,C.etal.ManganeseIncreasestheSensitivityofthecGAS-STINGPathwayforDouble-StrandedDNAandIsRequiredfortheHostDefenseagainstDNAViruses.Immunity48,675-687e677,doi:10.1016/j.immuni.2018.03.017(2018).
33Zhao,Z.M.,Z.;Wang,B.;Guan,Y.;Su,X.;Jiang,Z.Mn2+DirectlyActivatescGASandTriggersADistinctCatalyticSynthesisof2’3’-cGAMP.CellReportsAccepted(2020).
34Lv,M.etal.ManganeseiscriticalforantitumorimmuneresponsesviacGAS-STINGandimprovestheefficacyofclinicalimmunotherapy.CellResAccpeted(2020).