2021最新肺癌NCCN指南出炉!靶向新药层出不穷,强势逆转生存期!
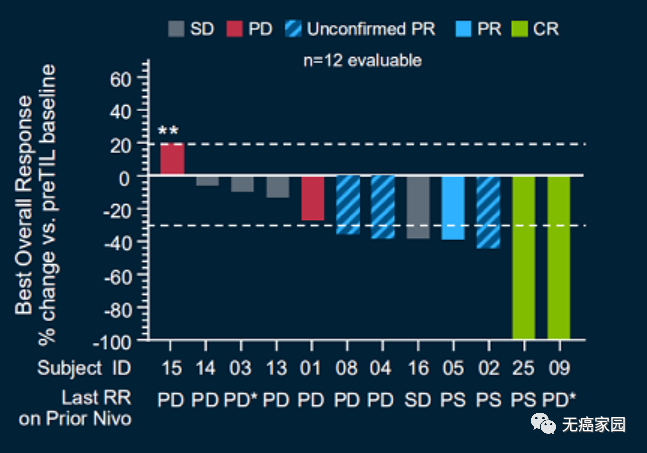
ROS1:曲替尼成为ROS1一二线脑转移优先推荐,效抗脑转2019年8月,FDA加速批准了全球第三款广谱“治愈系”抗癌药Entrectinib(Rozlytrek,恩曲替尼,RXDX-101)上市,用于治疗成人和儿童患者神经营养原肌球蛋白受体激酶(NTRK)融合阳性、初始治疗后局部晚期或转移性实体肿瘤进展或无标准治疗方案的实体瘤患者,以及ROS1阳性非小细胞肺癌(NSCLC)患者。PD-1高表达晚期NSCLC,药成为一线优先推荐,+Y双免推荐级别升至1级对于PD-L1高表达的晚期非小细胞肺癌患者,无论是鳞
0评论2026-01-1913
第四代EGFR抑制剂来了!奥希替尼耐药不用怕,六大处理方案全梳理!
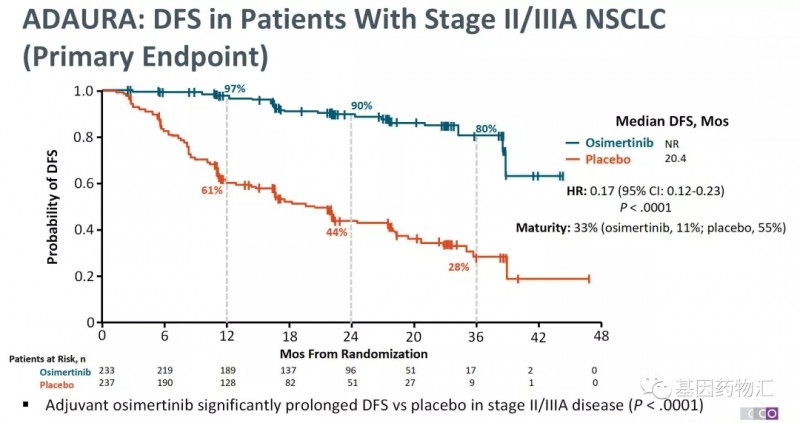
一肺腺癌女性62岁患者,先后进行了化疗、吉非替尼、厄洛替尼耐药后,出现T790M突变用奥希替尼治疗。SYMPHONY研究是BLU-945的首次人体1/2期开放性标签临床试验,旨在评估BLU-945单药和联合奥希替尼治疗对EGFR-TKI耐药的晚期NSCLC患者的安全性、耐受性和有效性。四、新靶点药或“四代”TKI1.U3-14022020WCLC报告了一项I期临床研究,评估晚期EGFR突变NSCLC患者在EGFR-TKIs奥希替尼治疗和铂类化疗失败后使用HER3抑制剂U3-1402(patritumab-
0评论2026-01-1927
12月6款创新药有望被FDA批准
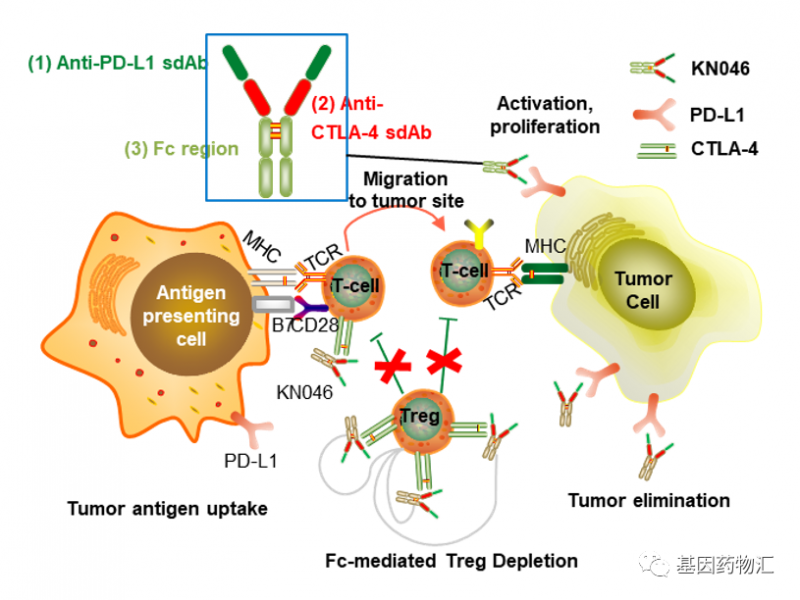
2.药物名称:特瑞普利单抗公司名称:君实生物/CoherusBioSciences适应症:鼻咽癌Toripalimab是一种抗PD-1单克隆抗体,能特异性结合T细胞表面的PD-1分子,从而阻断导致肿瘤免疫耐受的PD-1/PD-L1通路,重新激活淋巴细胞的抗肿瘤活性,达到治疗癌症的目的。NewDrugApplicationforAdagrasibasTreatmentofPreviouslyTreatedKRASG12C-MutatedNon-SmallCellLungCancer.RetrievedNov
0评论2026-01-196
又一款“广谱抗癌”潜力新药获突破性指定!HER2靶点新药迈出临床第一步!
Ⅰ期临床试验结果抢先看:多癌种抗癌潜力,疾病稳定率最高66.7%Zanidatamab的Ⅰ期临床试验中纳入了多种实体瘤的患者,包括胆管癌、胃食管交界处癌和结直肠癌等,所有患者平均接受过3线治疗方案,其中约59%的患者曾接受过前线HER2治疗(曲妥珠单抗)。该指定基于一项正在进行的Ⅰ期临床试验,使用Zanidatamab治疗多种曾经接受过治疗的不可切除的局部晚期和/或转移性HER2阳性实体瘤患者。就在今天,加拿大癌症生物疗法公司ZymeworksInc.宣布,FDA授予其研发的靶向HER2的双特异性抗体药物
0评论2026-01-197
一至四代EGFR靶向药物大汇总
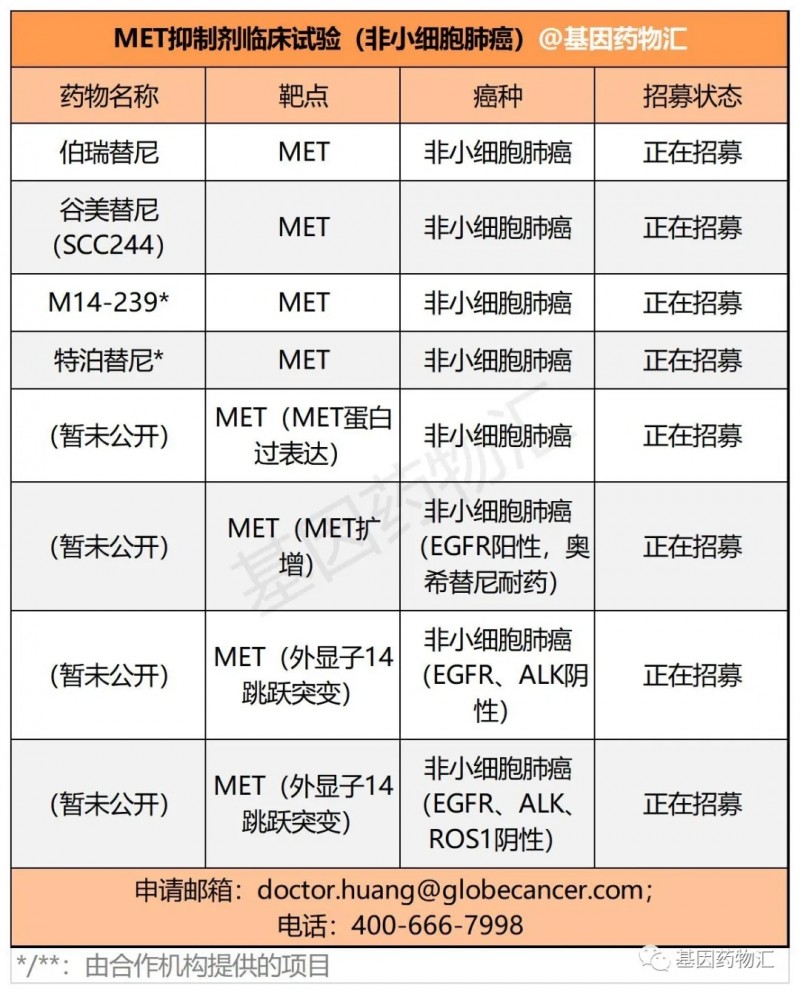
图五吉非替尼、奥希替尼、BLU-701、BLU-945对不同EGFR突变的IC50,绿色为强抑制,黄色中等抑制,紫色为弱或无抑制2022年的AACR大会报道了BLU-945的I期临床研究,剂量递增阶段33例患者的数据,这些患者先前接受过超过1种EGFR靶向药治疗,97%接受过奥希替尼治疗,64%有脑转移,55%为亚裔。一项来自中国的很小型的回顾性研究,纳入6例基线无症状脑转移EGFR突变患者,全部为非鳞癌,接受30mg达可替尼治疗,在5例疗效可评估患者中,2例脑转移完全缓解,3例脑转移稳定,颅内客观缓解率
0评论2026-01-199
速递 | 胆管癌新药获FDA优先审查!疾病控制率翻倍、潜力可期!
70%的患者转入Ivosidenib治疗组根据发表于《柳叶刀》杂志上的研究结果,与安慰剂相比,IDH1抑制剂Ivosidenib能够将IDH1突变型胆管癌患者的疾病进展或死亡的风险降低63%。速递|胆管癌新药,IDH1基因突变阳性胆管癌靶向药Ivosidenib(Tibsovo、AG-120)获FDA优先审查2021年5月5日,FDA宣布接受Ivosidenib(Tibsovo,IVO,AG-120)的补充新药申请,并授予其优先审查资格,用于治疗曾接受过前线方案治疗的IDH1突变阳性胆管癌患者。Ivosi
0评论2026-01-1714
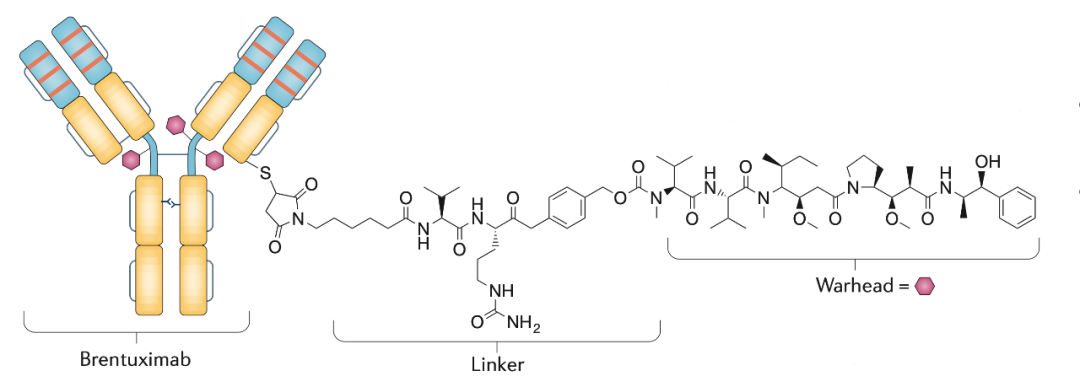
速递 | 完全缓解率24.1%!淋巴瘤ADC新药获FDA批准上市,后线治疗方案迎新!
联合方案潜力更佳,缓解率66.7%除了单药方案,Zynlonta联合依鲁替尼(Ibrutinib,Imbruvica)共同治疗复发或难治性大B细胞淋巴瘤及套细胞淋巴瘤患者的临床试验也在进行。速递|淋巴瘤新药,ADC药物Loncastuximabtesirine(Zynlonta)获FDA批准用于淋巴瘤后线治疗方案上市2021年4月24日,ADC疗法公司宣布,FDA加速批准了其研发的ADC新药loncastuximabtesirine(Zynlonta)上市,用于曾经接受过2线或以上全身方案治疗的复发或难治
0评论2026-01-1522
ODAC三日会议:那些曾获FDA加速批准的免疫“神药”,现在如何了?
IMpassion131试验中阿特珠单抗方案治疗的患者总生存期更短,两项试验中患者无进展生存期的优势都不够明显,这种药物的方案对于三阴性乳腺癌患者的益处很可能并没有我们期望的大。Hoimes博士强烈建议将派姆单抗的批准保留,他表示,他代表他的患者以及医生团队,期望FDA能够为患者们保留这种可以选择的治疗方案。阿特珠单抗治疗能够使患者获得数年的疗效(IMvigor210试验:中位缓解持续时间59.1个月),这是铂类化疗方案望尘莫及的。结果:7票赞成,2票反对基于IMpassion130试验中无进展生存期和总
0评论2026-01-1524
速递 | Balstilimab宫颈癌适应症提交FDA审批!免疫家族有望再添新药,双免疫方案进入加速通道
早期临床试验结果显示,双免疫联合方案治疗复发或难治性转移性宫颈癌患者,整体缓解率为26.5%。新型双免疫方案:已进入快速通道2020年3月,FDA曾经授予Balstilimab与Zalifrelimab的联合方案快速通道称号,用于治疗复发或难治型转移性宫颈癌患者。这款药物的临床试验主要分为两个类型,一类为Balstilimab单药治疗方案的临床试验,一类为Balstilimab与CTLA-4抑制剂Zalifrelimab联合应用的双免疫治疗方案,主要用于复发或转移性宫颈癌的治疗。双免疫治疗宫颈癌方案进入加
0评论2026-01-1518
速递 | 尿路上皮癌新药获批,化疗及免疫耐药患者有新选择了!
速递|尿路上皮癌新药,抗体偶联ADC药物Trodelvy(SacituzumabGovitecan)获得FDA加速批准上市2021年4月14日,FDA加速批准了抗体-药物偶联物(ADC)SacituzumabGovitecan(Trodelvy)的新适应症,用于治疗曾经接受过铂类化疗及PD-1/PD-L1抑制剂治疗的局部晚期或转移性尿路上皮癌患者。该研究证实,Trodelvy治疗这部分已经经过多种方案治疗的尿路上皮癌患者,取得了比较理想的缓解率和缓解持续时间。不论是在三阴性乳腺癌还是尿路上皮癌的治疗中,T
0评论2026-01-1233