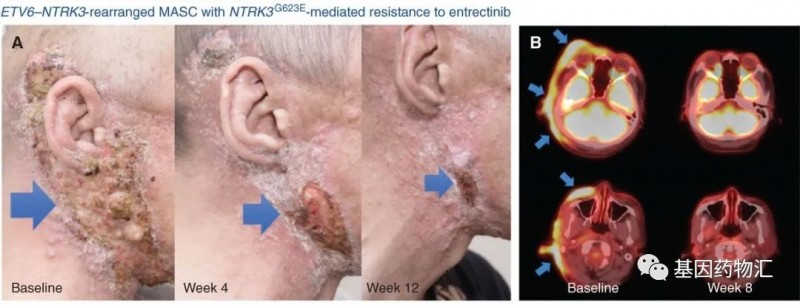
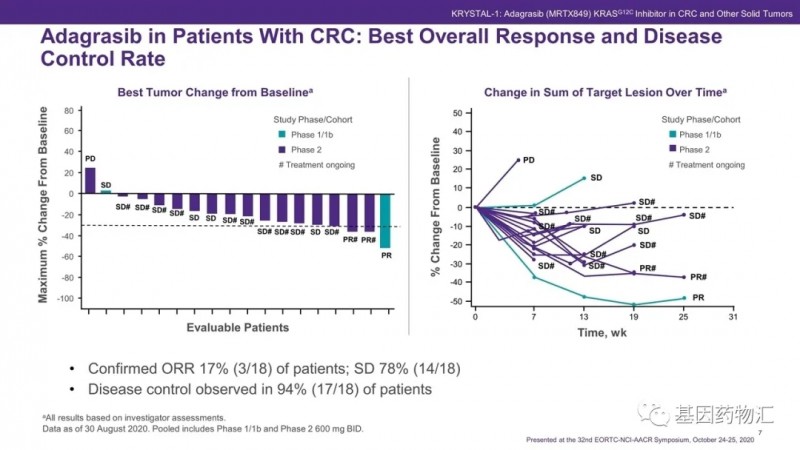
普米斯生物PM1022临床试验,价PM1022注射液治疗晚期肿瘤耐受性、安全性、药代动力学特征和初步疗效的I期临床试验及在晚期肿瘤中考察初步疗效的IIa期临床试验
试验目的
I期目的
评价PM1022在晚期肿瘤受试者治疗中的耐受性和安全性。
IIa期目的
初步评估PM1022在特定晚期肿瘤受试者治疗中的疗效。
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、自愿参加临床试验;完全了解本试验并自愿签署知情同意书;愿意遵循并有能力完成所有试验程序;
2、男性或女性,年龄18至75岁(含边界值);
3、经组织学或细胞学证实的恶性肿瘤受试者;
4、有充足的器官功能;
5、体力状况美国东部肿瘤协作组(ECOG)评分为0-1;
6、预期生存期≥12周;
7、根据RECIST1.1,至少有一个可测量肿瘤病灶;
8、所有受试者应在筛选期进行新鲜肿瘤病灶活检;如无法进行活检,应提供距离开始研究治疗最近的经福尔马林固定-石蜡包埋(FFPE)处理的肿瘤样本用于生物标志物分析;
9、有生育能力的女性受试者必须在首次开始研究治疗前7天内的血妊娠结果为阴性,且愿意从签署知情同意书起至末次用药结束后5个月内,保持禁欲或采取经医学认可的高效避孕措施(如宫内节育器、避孕套);
10、男性受试者愿意从签署知情同意书起至末次用药结束后5个月内,保持禁欲或采取经医学认可的高效避孕措施,且在此期间不捐献精子;
排除标准
1、严重过敏性疾病史、严重药物过敏史或已知对本试验用药任何成分过敏;
2、I期受试者既往接受过免疫共刺激分子激动剂,或免疫检查点抑制剂治疗;
3、既往接受免疫治疗者,发生过≥3级的免疫治疗相关不良事件(irAE);
4、既往抗肿瘤治疗的不良反应尚未恢复到NCI-CTCAEV5.0等级评价≤1级;
5、目前有明确的间质性肺病或非感染性肺炎,局部放疗引起的除外;
6、在开始治疗前接受过以下治疗或药物:
1)开始研究治疗前28天之内接受过重要脏器外科手术(不包括穿刺活检),或需要在试验期间接受择期手术;
2)开始研究治疗前28天内接种减毒活疫苗;
3)首次给药前4周内接受过抗肿瘤治疗;
4)开始研究治疗前14天内接受过全身使用的糖皮质激素;
7、具有临床症状的脑实质转移或脑膜转移,经研究者判断不适合入组;
8、患有活动性、或曾患过且有复发可能的自身免疫性疾病的患者;
9、开始研究治疗前5年内,曾患有其他活动性恶性肿瘤;
10、有严重的心脑血管疾病史;
11、未得到控制的肿瘤相关疼痛;
12、目前存在无法控制的胸腔、心包、腹腔积液;
13、在筛选期间或开始研究治疗前,出现不明原因的发热38.5°C(经研究者判断,因肿瘤原因导致的发热可以入组);
14、已知有异体器官移植史或异体造血干细胞移植史;
15、已知有酒精滥用、精神类药物滥用或吸毒史;
16、精神障碍者或依从性差者;
17、有免疫缺陷病史,包括HIV抗体检测阳性;
18、活动性梅毒感染;
19、活动性乙型肝炎或丙型肝炎;
20、经研究者判断,受试者基础病情可能会增加其接受试验用药治疗的风险,或是对于出现的毒性反应及AE的解释造成混淆的;
21、妊娠期或哺乳期女性;
22、其他研究者认为不适合参加本研究的情况;
23、人类免疫缺陷病毒(HIV)感染或已知有获得性免疫缺陷综合征(艾滋病)。
最科学肝癌的用药
它既可作为中、晚期肝癌病人的主要治疗方法,又可作为手术、放射、化疗的辅助治疗,以提高疗效,减轻毒副反应。所以肝癌晚期的治疗方法更有赖于肝癌的用药,药物治疗主要包括中药与化疗。20世纪90年代以来,临床围绕如何将大肝癌变成小肝癌,从而使更多不能切除的肝癌变为可切除这一研究热点,对健脾法在此方面的作用做了更进一步地探索,出现了可喜的苗头。手术前后肝癌的用药治疗的作用近年证实肝癌术前用健脾理气法治疗,能缩小瘤体,有利于切除和术后的恢复。临床研究结果表明,对Ⅱ期肝癌的用药中药组较化疗组为优。目前的统计,临床上以中
0评论2025-09-153
红枣可以防癌吗?中药对肿瘤
大枣中含有皂甙类、黄酮类、维生素及大量的糖类物质,3、5-磷酸腺苷(camp)及微量元素,如磷、钾、钙、铁、锰等。它可蒸可煮,可制甜羹,也可煮粥,都香甜味美可口,又别具风味,至于大枣小豆粥、糯米大枣粥,自古以来就是老年人虚弱人的疗养保健饮食。大枣,具有补脾益胃、养心安神、补气养血、缓和药性的作用,是一种常用的中药。红枣可以防癌吗。为提高其疗效,可与参类合用。因此,有关人士提倡,常食大枣预防胃的恶性肿瘤。
0评论2025-09-153
不建议肝癌晚期喝中药
对于一些中成药以及西药,也应该观察说明书,观察有没有肝功的损害,肝癌的患者建议吃一些维生素a、维生素c含量比较丰富的蔬菜水果,也要进食一些高热量的食物,补充一些优质蛋白质,不然体质会衰弱的比较明显。肝癌的患者是不建议吃中药的。肝癌患者应该根据患者的肝功情况给予保肝治疗,必要时给予一些抗病毒以及提高免疫力的药物来治疗。因为中药对肝脏有一定的损害,可引起转氨酶的升高,可以导致谷丙转氨酶,谷草转氨酶以及谷氨酰转肽酶的升高。所以不建议应用中药来治疗。
0评论2025-09-153
抗肿瘤最强的中草药
人参皂苷rg3是从人参中提取出来的单体成分,人参有补元气、固脱生津之功,是古代用于治疗虚证之要药,能补阳中之阴、阴中之阳,补益脾胃,益气补血,减少化疗毒副作用。人参在药理学上可增强放化疗对肿瘤细胞的杀伤作用,同时明显减轻放化疗的毒副作用,并能进一步抑制肿瘤细胞的生长、侵袭和转移。对癌症的治疗一直以来都是以西医为优先的治疗方法,因为西医的观念中中医中药成分不明确,药理不清,所以在治疗时不会考虑太多,但是随着人参中人参皂苷rg3等抗肿瘤成分的出现,中药抗肿瘤的功效才得到人们的重视。冬虫夏草冬虫夏草具有很好的药
0评论2025-09-158
长期服用口服避孕药易得宫颈癌
此外,研究人员还发现,患有人型疱疹病毒的妇女加上服用口服避孕药会使子宫颈癌发生的机会增加90%。评估结果表明,与那些从不服用口服避孕药的妇女相比,那些使用口服避孕药不到5年的妇女患子宫颈癌的机会为10%,而口服避孕药已使用了5至9年的妇女的子宫颈癌发生机会为60%,如果口服避孕药的使用期延长至10年以上,子宫颈癌的发生率则可高达120%。而那些已经长期使用口服避孕药的妇女则应该定期做子宫颈癌的检查。英国科学家对1.25万名妇女所做的28项临床研究结果进行了评估,以确定在使用口服药和造成子宫颈癌之间是否有着
0评论2025-09-1311
大蒜人参会影响抗癌治疗 草药癌症不宜吃
“第五届晚期乳腺癌国际共识会议(ABC5)于11月14日在葡萄牙里斯本召开,会上,国际乳腺癌领域专家不无担忧地说,他们呼吁患者要”理性对待这类并无科学证据支持的补充疗法,尤其是在开始接受常规药物治疗或化疗前,需向主诊医生说明白曾经或正在服用哪些草药。此外,她指的弊大于利,主要针对补充疗法导致部分患者推迟或拒绝癌症常规疗法、耽误治疗、增加死亡风险的情况以及未及时告知医生导致药物相互作用的情况。因此呼吁患者在接受激素治疗、化疗和药物治疗等常规治疗前,务必清晰地告知医生曾经或正在使用的草药,以免耽误治疗。Car
0评论2025-09-139
中药治疗胰腺癌效果怎样
若肿瘤侵犯、压迫血管、神经、器官后,不仅发生相应的组织器官的功能改变,而且会出现疼痛。癌细胞发展过程中引起的疼痛肿瘤侵犯组织后,感受器被伤害而激活,释放出脑啡肤、缓激肤、P物质及素等介质,这些介质兴奋疼痛中枢而产生疼痛。专家介绍说:导致这种情况的发病原因是:癌细胞侵及、破坏食管壁或引起食管深层,癌细胞引起食管周围炎、炎以及邻近器官和组织,癌细胞转移引起相关组织器官引起疼痛。1)食道癌细胞生长致痛:癌细胞的生长对肌体的影响极大,与良性肿瘤有很大区别,良性肿瘤以膨胀性生长为发展方式,因此会对局部的组织器官产生
0评论2025-09-1310