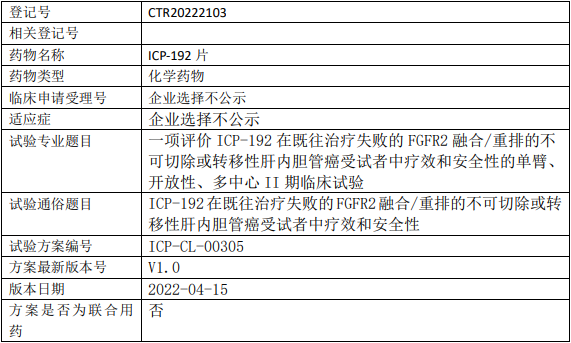
天诚医药ICP-192临床试验,评价ICP-192片治疗既往治疗失败的FGFR2融合/重排的不可切除或转移性肝内胆管癌疗效和安全性的单臂、开放性、多中心II期临床试验
试验目的
评价ICP-192片在既往治疗失败的FGFR2融合/重排的不可切除或转移性肝内胆管癌受试者中的客观缓解率(ORR)。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、自愿入组并签署知情同意书。
2、年龄≥18周岁,性别不限。
3、ECOG体力评分为0-1分。
4、预计生存期3个月以上。
5、组织或细胞病理学证实的肝内胆管癌,且不可切除、复发或转移性(AJCC2017年第8版TNM分期IV期)肿瘤经至少一线系统化疗后疾病进展,新辅助/辅助化疗后6个月内进展/复发可以入选。
6、中心实验室检测存在FGFR2基因融合/重排。
7、根据RECISTV1.1标准,筛选期至少有一个可测量病灶作为靶病灶。
8、器官功能水平必须符合方案要求。
9、避孕。
排除标准
1、存在需要治疗的其他恶性肿瘤。
2、既往接受过选择性FGFR抑制剂。
3、既往在方案规定的时间内接受过抗肿瘤治疗。
4、已知有症状的中枢神经系统转移。
5、既往抗肿瘤治疗的毒性尚未恢复,首次研究药物给药时存在≥2级的不良事件(CTCAEV5.0评价标准判断)。
6、目前患有无法控制的心脑血管疾病或有既往病史。
7、根据研究者判断,有任何不稳定或不能控制的系统性疾病。
8、目前有活动性出血。
9、有活动性感染的伤口。
10、在研究药物首次给药前4周内进行了大型外科手术,或研究药物首次给药前2周内进行了小型外科手术。
11、可能增加眼部毒性风险的任何角膜或视网膜异常。
12、既往有广泛组织钙化史和/或当前存在广泛组织钙化证据。
13、临床上严重的胃肠道功能异常。
14、活动期HBV感染、活动期HCV感染、HIV感染。
15、女性受试者处于妊娠期或哺乳期。
16、末次使用强效CYP3A抑制剂或CYP3A诱导剂距离首次试验用药时间不足5个半衰期,或者计划参与本研究期间同时服用强效CYP3A抑制作用或诱导作用的药物或食物。
17、已知对研究药物辅料过敏。
18、研究者认为其他不适合参加本研究的情况。
大肠癌中药外治法
用法:蛇床子、苦参、薄荷加水1000ml,煮沸后加入大黄,再熬2分钟后又将雄黄、芒硝放入盆中,将药汁倒入盆中搅拌,乘热气上冒之际蹲于盆上,熏蒸肛门处,待水变温后,换为坐浴。雄黄辛温,解毒辟秽,薄荷辛凉疏解。老葱,活蟾蜍,,(研末)用法:活蟾蜍破腹后纳入麝香、斑蝥外敷关元穴,将炒热的老葱敷贴于上,上置热水袋以保持葱的温度。全方共成清热利湿,解毒辟秽,消肿止痛之功。分析:蟾蜍、麝香辛温辟秽化浊,通经活络。肠癌不是突发,而是因火气招来的肠热,诱发长期炎症,不及时治疗就癌变。
0评论2025-08-302
原发性肝癌的中医药治疗
辨病与辨证的治疗原则早期一旦确诊,必须抓住肝癌的实质,尽管早期没有明显的症状可辨,在辨病的基础上同样要用祛邪为主的抗癌中药,同时配以健脾养胃,舒肝理气,活血散结之品。为此,治疗肝癌不宜用破血峻猛之中药,以免增加肝癌患者的出血危象,甚至可能导致癌细胞转称扩散,为此选用活血化方位药之时可选用三七粉、茜草、仙鹤草、生蒲黄、当归、大黄,具有活血止血的双重性作用的中药更为安全。为此调理肝脾之法不仅体现了中医治疗肝癌的整体观念,而且高速了脾虚所引起的代谢与免疫失调所出现的证候。活血与止血的治疗原则血瘀是肝癌重要的病机
0评论2025-08-301
癌痛药物治疗的三阶梯疗法
重度的剧烈疼痛应由第二阶梯向第三阶梯治疗过渡,正规使用强效阿片类镇痛药,目前口服药中较常用的是美施康定,每片含吗啡30mg,每次l-2片,每12h口服一次,若不能口服时,可经肛门给药。第一阶梯治疗原则上是口服非自体类抗炎镇痛药,该类镇痛药作用于末梢,具有解热镇痛抗炎的效果,能抑制下丘脑前列腺素合成酶的生成,减少前列腺素E的合成与释放,对前列腺素含量较高的骨转移患者的疼痛非常有效。此类疼痛患者需应用镇痛药物,但用药原则上应采取逐步向第二阶梯过渡的原则,即在给予非自体类抗炎镇痛药的同时,辅助给予镇痛药,如曲马
0评论2025-08-300
滥用止痛药可致死 癌症如何规范止痛
6、发生不良反应的对策一些止痛药可能会产生某些不良反应,尤其是麻醉止痛药,可表现有恶心、呕吐、反酸、消化不良、便秘、头痛、头晕、皮诊、呼吸急促等,应及时停止使用该种药物,请示医生,更换其他药物,以免加重病情,引起其他不良后果。辨清疼痛原因世界疼痛医师协会中国分会会长、首都医科大学宣武医院疼痛科主任倪家骧教授介绍,比如,腹痛可能由胰腺炎、胆囊炎等多种疾病引起,盲目服用止痛药会掩盖症状,延误治疗。1、及时准备按医生的嘱咐足量给药在家庭护理中,必须根据医嘱正确掌握药物的种类、剂量、给药途径和给药时间,因为持续疼
0评论2025-08-300
癌痛的药物治疗,肿瘤检查
第三阶梯药物以强阿片类药物为主,以吗啡为代表,目前临床上吗啡已有口服和其他剂型,用于治疗重度癌痛。肿瘤的治疗方法,肺癌,胰腺癌,乳腺癌,宫颈癌,子宫内膜癌,大肠癌,胃癌,肺癌,鼻咽癌,卵巢癌,前列腺癌,癌痛的药物治疗的三阶梯临床上,根据主诉疼痛分级法分为:0级无痛。杜冷丁不宜治疗慢性癌痛在临床上,有些家属要求医生给晚期癌痛病人肌肉注射杜冷丁,癌痛的药物治疗,认为杜冷丁是最好的止痛药,其实不然。疼痛仍持续或加剧,就上升到第二阶梯药物,以弱阿片类药物为主,以可待因为代表,用于中度癌痛。在医学日益发展的今天,我
0评论2025-08-301
癌症疼痛如何缓解?中药对肿瘤
肿瘤的治疗方法,肺癌,胰腺癌,乳腺癌,宫颈癌,子宫内膜癌,大肠癌,胃癌,肺癌,鼻咽癌,卵巢癌,前列腺癌,二、松弛疗法广告松弛疗法能解除精神上的紧张,伸展骨骼肌,阻断和缓解疼痛,并可引发体内多种生理生化反应。肾肿瘤医院,偏恶性肿瘤,7cm肿瘤,宜宾肿瘤,骶骨肿瘤,罗氏肿瘤,那么,得了癌症到底有什么办法可以缓解患者的疼痛呢。三、心理疗法得了这病的病人毋庸置疑情绪是相当糟糕的,我们要尽量在交流中用相宜的方式让癌症病人发泄负面情绪,癌症如何死,癌症大细胞,得癌症女生,癌症临终三天症状,癌症病人可以吃海参吗,并做好
0评论2025-08-282
胃癌中医中药治疗
而且还可与胃癌手术、放疗、化疗等治疗手段联合应用,能够显著提高综合疗效,尤其在减轻放化疗对机体的毒副作用,提高患者的免疫及改善其生活质量等方面的效果明显,能够有效防止肿瘤的复发、转移。中医认为胃癌手术治疗是一种损伤性治疗,术后患者元气大伤,此时患者不宜采用放、化疗等对身体损伤较大的攻伐之法。化疗是胃癌常用的治疗方法之一,一般用于手术后的辅助治疗或者失去了手术机会的患者。一般的来说,胃癌手术治疗后的胃癌患者如能够在进食半流质饮食后可以服用中药辅助治疗。但胃癌化疗的毒副作用很大,有些患者甚至因不能耐受化疗的副
0评论2025-08-282
胃癌术后易贫血,肿瘤用药
肿瘤,肿瘤的症状,肿瘤医院,肿瘤标志物,恶性肿瘤,良性肿瘤,肿瘤杂志,湖南肿瘤医院,得了肿瘤怎么办,肝癌,胃大部分切除后,胃壁细胞减少,使得铁质吸收发生障碍,很容易出现缺铁性贫血。肿瘤消炎药,白介素肿瘤,黄金肿瘤,头颈部恶性肿瘤,植物抗肿瘤,安德森肿瘤,因此,患者和家属应留意身体的不适症状,别把贫血误当成手术的正常反应。疲乏、困倦、唇甲发白、食欲减退是贫血患者的常见症状,这些症状也会出现在胃癌患者身上,特别是进行了胃切除手术的胃癌患者。此外,胃黏膜受损造成消化功能不良,影响营养物质吸收,也容易导致贫血。
0评论2025-08-281
中药如何有效治疗胃癌?
故临证应多注意兼顾,用药亦多寒温并用,升降并用,补泻并用,根据本病的病因病机及临床所见,其分型如下:1.肝胃不和型主证:胃脘胀满,痛连两胁,口苦心烦,嗳气频作,饮食少进或反胃,舌苔薄白或薄黄,脉弦细。胃癌中医药物在临床上常被采用晚期患者的辅助治疗,以下简介胃癌中医药物治疗的方法。患上胃癌跟饮食有很大关系,中药如何有效治疗胃癌呢。中医药物治疗胃癌胃癌的治疗方法除了手术和放化疗,随着医学科技的发展,胃癌中医药物治疗也被广大的患者所接受,并且胃癌中医药物对晚期患者的效果还是很好的。法半夏、党参、白术、云苓、黄芪
0评论2025-08-287
甲状腺癌术后须终身服药 剂量合适不必担心副作用
然,专家表示,甲状腺癌患者需要终身服用甲状腺素,期间药量会有调整,但不能停药。国外,对于分化型甲状腺癌都比较倾向于做双侧,避免术后残留甲状腺复发和二次手术的风险,但在国内,医生更加谨小慎微,不愿冒太大风险,因为施行甲状腺全切除术会增加喉返神经和甲状旁腺损伤的风险。有人担心终生服用甲状腺素有副作用,其实不必太过忧虑,因为甲状腺素只要剂量合适,副作用就很小,甚至几乎没有副作用,就可以让患者的甲状腺功能回复到正常水平。不过,专家表示,术后补充甲状腺素的剂量会根据患者的情况调整,只要剂量合适,副作用就很小,甚至可
0评论2025-08-282
