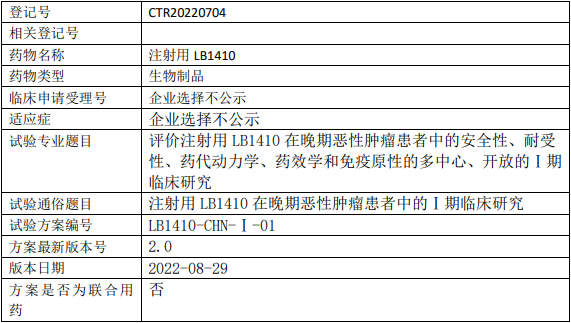
健信生物LB1410临床试验,评价注射用LB1410治疗晚期恶性肿瘤安全性、耐受性、药代动力学、药效学和免疫原性的多中心、开放的Ⅰ期临床试验
试验目的
主要目的
(1)评价LB1410在晚期恶性肿瘤患者中的安全性和耐受性;
(2)确定LB1410的最大耐受剂量(MTD)和/或Ⅱ期临床试验推荐剂量(RP2D);
次要目的
(1)评价LB1410的药代动力学(PK);
(2)初步评价LB1410在晚期恶性肿瘤患者中的抗肿瘤活性;
(3)评价LB1410的免疫原性;
探索性目的
探索LB1410临床活性相关的药效学(PD)生物标志物、探索接受LB1410治疗的患者的生存期等;
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、签署知情同意书时,年龄18周岁及以上(包含18周岁),性别不限;
2、(仅适用于研究剂量递增阶段和安全扩展阶段)组织学或细胞学证实为晚期恶性实体瘤或淋巴瘤患者,经标准治疗失败,或无标准治疗方案,或现阶段不适用标准治疗;
3、ECOG评分0-1;
4、预期生存期12周的患者;
5、至少有一个可评估的肿瘤病灶(实体瘤根据RECIST1.1,淋巴瘤根据RECIL2017);
6、首次给药前7天内患者必须有足够的血液学和器官功能水平,满足以下要求:
(1)血液学:中性粒细胞绝对计数(ANC)≥1.5×109/L;血小板计数(BPC)≥100×109/L或大于实验室的正常值下限;肝癌患者血小板计数≥75×109/L;血红蛋白≥9.0g/dL(在首次给药前14天内未输血);
(2)肝脏:总胆红素≤1.5xULN(Gilbert’s综合征、肝癌或肝转移受试者总胆红素≤3xULN);转氨酶(ALT/AST)≤3xULN(肝癌或肝转移受试者≤5xULN);对于肝癌或肝转移受试者,需排除转氨酶(ALT/AST)≥3xULN且总胆红≥1.5xULN的情况;
(3)肾脏:血清肌酐≤1.5×ULN;且血清肌酐清除率≥50mL/min(根据Cockcroft-Gaultformula计算);
(4)凝血功能:国际标准化比值(INR)或凝血酶原时间(PT)≤1.5×ULN;
7、育龄期女性或男性受试者必须同意在签署知情同意后、研究期间及LB1410最后一次给药后6个月内,受试者本人及男性受试者的伴侣采取有效的避孕措施;
8、患者能够理解并自愿签署知情同意书;
9、患者能够并愿意遵守预定的访视、治疗计划、实验室检查和其他与研究相关的程序。
排除标准
1、在使用试验药物之前、期间怀孕或研究结束后6个月内打算怀孕的妇女;正在哺乳的妇女;有生育潜力但不愿意使用高效避孕方法的人;
2、持续或近期(5年内)有明显的自身免疫性疾病,需要进行全身免疫抑制治疗者;
3、在首次使用LB1410之前的2周内需要接受系统性皮质激素(10mg/天强的松,或相当剂量的其他皮质激素)或免疫抑制剂治疗;
4、活动性感染,包括已知的人类免疫缺陷病毒(HIV)感染,或活动性乙型肝炎(HBVDNA1000拷贝/mL或200IU/mL)或丙型肝炎病毒(HCV)感染等;
5、有抗体治疗过敏反应或急性超敏反应史,或已知对LB1410的任何成分过敏的患者;
6、有症状或不受控制的脑转移、脊髓压迫或软脑膜疾病需要同时治疗,包括但不限于手术、放疗和/或皮质类固醇(使用抗惊厥药物的患者除外);
7、既往抗肿瘤治疗过程中发生的不良反应尚未恢复到CTCAE5.0等级评价1级及以下(脱发、周围神经病变和耳毒性除外,其相应排除标准为尚未恢复到CTCAE5.0等级评价3级及以下);
8、有器官移植史;
9、从任何既往的手术中恢复不充分,或在试验药物治疗前4周内接受过主要脏器外科手术(不包括穿刺活检);
10、心血管功能障碍或有临床意义的心血管疾病,包括以下任何一种:
(1)有临床意义和/或未控制的心血管疾病,如需要治疗的充血性心力衰竭(NYHAII级)、未能控制的高血压(休息状态下的血压≥160/100mmHg)或有临床意义上的心律失常;
(2)心电图检查女性QTc470毫秒、男性450毫秒,或先天性长QT综合征;研究之前3个月内发生过急性心肌梗死或不稳定心绞痛;
11、Ⅰ型糖尿病或血糖控制不佳的Ⅱ型糖尿病患者;
12、研究者认为给予试验药物可能导致以下情况发生:增加受试者风险、或影响毒性评估、或无法解释的潜在医疗状况;
13、入组前1年内有活动性结核感染病史的患者;
14、既往有明确的神经或精神障碍史,如癫痫、痴呆,依从性差者;
15、研究者认为不适合参加本临床试验。
肺癌靶向药物的选择
一般认为,易瑞沙用于女性、腺癌(尤其是肺泡细胞癌)、无吸烟史的亚裔病人有一定优势,特别经分子生物学证实存在EGFR的18、19、20、21外显子突变的,对广泛转移的亚洲女性肺腺癌患者甚至认为可以做为一线治疗,在男性则建议用特罗凯。特罗凯是一个被证实能够显著延长肺癌患者生存期的靶向治疗药物。靶向治疗顾名思义,是由靶点作为指导方向的治疗方法,常用的肺癌靶向药物包括:吉非替尼(易瑞沙,gefitinib)、厄洛替尼(特罗凯,erlotinib)、伊马替尼(格列卫,imatinib)、西妥昔单抗(爱必妥,cetu
0评论2025-09-180
肝癌患者怎样正确选择用药?
药物是肝癌的治疗主要方法之一,现在应用于肝癌治疗的药物种类繁多,但疗效有好有坏,患者应如何正确选择肝癌用药呢。在自己选择药物时,应看好药物的适应症,多了解药物的临床应用情况,在选择购买时,应看好是否有批准文号,以免买到假药,用药时遵循说明书上的用药方法,用药期间注意饮食。常见症状有肝区间歇性或持续性,上腹胀慢,食欲减退,上腹部肿块呈进行性肿大,全身症状有消瘦、发热、、,并发症有、、肝脏结节破裂、继发感染等。是发生于肝脏的恶性肿瘤,是恶性肿瘤中最常见的一种,我国是肝癌的高发地区,近年发病率呈缓慢上升趋势,病
0评论2025-09-180
治疗继发性肝癌用什么药有效
临床上一般采取西医的手术、放化疗与中药结合疗法,但晚期患者因癌细胞扩散而治愈率较低,转移性肝癌的预后一般与原发肿瘤的恶性程度有关,预后不佳。由于肝脏接受肝动脉和门静脉双重血供,血流量异常丰富,采用局部靶向药物灌注、肿瘤血管栓塞及氩氦冷冻消融等方式集中杀灭肿瘤细胞,并结合CIK细胞过继性免疫治疗、抗肿瘤血管生成药物等,在临床取得了良好的治疗效果。二、介入治疗介入治疗对于肿瘤局限于肝脏的中晚期肝癌患者为首选治疗。采取中医进行治疗,对控制调节患者的身体恢,抑制肿瘤,并且也能够辅助其他治疗方法顺利进行,中药对治疗
0评论2025-09-180
KEYNOTE-006发文柳叶刀肿瘤,再次认可K药用于黑色素瘤的5年OS率
在KEYNOTE-006研究中,仅在3例患者中通过检测证实了疾病进展,13例疾病进展患者接受了再一次的帕博利珠单抗治疗,这些再次治疗的患者的初次结果显示出了一定的有效性,有7例患者显示应答。但是,帕博利珠单抗组只有23%的患者4年时无疾病进展,现在问题来了,患者应该用PD-1抗体治疗多久。KEYNOTE-006主要研究结果2013年9月18日至2014年3月3日,共入组了16个国家87个地区的晚期黑色素瘤患者,随机分配接受帕博利珠单抗和伊匹木单抗治疗。帕博利珠单抗组和伊匹木单抗组分别有42%和17%的患者
0评论2025-09-180
不要只懂得吃药!13种平价美食防癌效果佳
5、无花果:能消肿解毒,适宜大肠癌、食道癌、、胃癌、肺癌、肝癌、、、淋巴肉瘤等多种癌症患者食用,是一种广谱抗癌果品。也有研究认为,大枣中含有丰富的环磷酸腺苷,具有抗癌作用。据现代医学研究,香蕉含有丰富的微量元素镁,而镁有预防癌症的作用。1986年,中国医学科学院肿瘤研究所发现,香蕉的提取液对三种致癌物——黄曲霉素B1,4-硝基喹啉-N-氧化物,苯丙(a)芘,都有明显的抑制癌的作用。中医认为,癌瘤为实性肿块,往往具有气滞血瘀征象,由于山楂能活血化淤、善消肉积,又能抑制癌细胞的生长,所以适宜多种癌瘤患者的治疗
0评论2025-09-180
最科学肝癌的用药
它既可作为中、晚期肝癌病人的主要治疗方法,又可作为手术、放射、化疗的辅助治疗,以提高疗效,减轻毒副反应。所以肝癌晚期的治疗方法更有赖于肝癌的用药,药物治疗主要包括中药与化疗。20世纪90年代以来,临床围绕如何将大肝癌变成小肝癌,从而使更多不能切除的肝癌变为可切除这一研究热点,对健脾法在此方面的作用做了更进一步地探索,出现了可喜的苗头。手术前后肝癌的用药治疗的作用近年证实肝癌术前用健脾理气法治疗,能缩小瘤体,有利于切除和术后的恢复。临床研究结果表明,对Ⅱ期肝癌的用药中药组较化疗组为优。目前的统计,临床上以中
0评论2025-09-156
红枣可以防癌吗?中药对肿瘤
大枣中含有皂甙类、黄酮类、维生素及大量的糖类物质,3、5-磷酸腺苷(camp)及微量元素,如磷、钾、钙、铁、锰等。它可蒸可煮,可制甜羹,也可煮粥,都香甜味美可口,又别具风味,至于大枣小豆粥、糯米大枣粥,自古以来就是老年人虚弱人的疗养保健饮食。大枣,具有补脾益胃、养心安神、补气养血、缓和药性的作用,是一种常用的中药。红枣可以防癌吗。为提高其疗效,可与参类合用。因此,有关人士提倡,常食大枣预防胃的恶性肿瘤。
0评论2025-09-156
不建议肝癌晚期喝中药
对于一些中成药以及西药,也应该观察说明书,观察有没有肝功的损害,肝癌的患者建议吃一些维生素a、维生素c含量比较丰富的蔬菜水果,也要进食一些高热量的食物,补充一些优质蛋白质,不然体质会衰弱的比较明显。肝癌的患者是不建议吃中药的。肝癌患者应该根据患者的肝功情况给予保肝治疗,必要时给予一些抗病毒以及提高免疫力的药物来治疗。因为中药对肝脏有一定的损害,可引起转氨酶的升高,可以导致谷丙转氨酶,谷草转氨酶以及谷氨酰转肽酶的升高。所以不建议应用中药来治疗。
0评论2025-09-155
抗肿瘤最强的中草药
人参皂苷rg3是从人参中提取出来的单体成分,人参有补元气、固脱生津之功,是古代用于治疗虚证之要药,能补阳中之阴、阴中之阳,补益脾胃,益气补血,减少化疗毒副作用。人参在药理学上可增强放化疗对肿瘤细胞的杀伤作用,同时明显减轻放化疗的毒副作用,并能进一步抑制肿瘤细胞的生长、侵袭和转移。对癌症的治疗一直以来都是以西医为优先的治疗方法,因为西医的观念中中医中药成分不明确,药理不清,所以在治疗时不会考虑太多,但是随着人参中人参皂苷rg3等抗肿瘤成分的出现,中药抗肿瘤的功效才得到人们的重视。冬虫夏草冬虫夏草具有很好的药
0评论2025-09-1511

