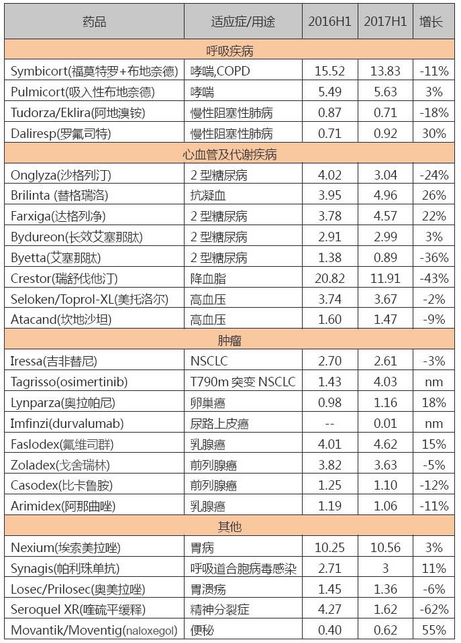
近日,美国宾夕法尼亚大学科学家开展的一项I期临床研究显示,嵌合抗原受体T细胞疗法治疗胶质母细胞瘤在首个人体临床研究中成功跨越血脑屏障到达脑部肿瘤,安全性良好,同时降低了GBM细胞中表皮生长因子受体III型突变体的表达水平。该研究同时发现,EGFRvIII在患者间的表达差异很大。另外肿瘤针对CAR-T细胞输注表现出了积极的免疫抑制变化,这些因素可能代表着CAR-T疗法在临床可用性方面的一大障碍。
这项研究已于近日发表于《科学转化医学》(ScienceTranslationalMedicine),论文标题为“ASingleDoseofPeripherallyInfusedEGFRvIII-DirectedCARTCellsMediatesAntigenLossandInducesAdaptiveResistanceinPatientswithRecurrentGlioblastoma”《单剂量静脉输注EGFRvIII定向CAR-T细胞治疗复发性胶质母细胞瘤患者介导了抗原减少并诱导了适应性抵抗》。
该项研究中的自体EGFRvIII靶向性CAR-T疗法由宾夕法尼亚大学和诺华合作开发。之前双方已开发出了CAR-T疗法CTL019(tisagenlecleucel)。就在上周,CTL019获得了FDA肿瘤学药物专家委员会一致推荐批准,用于复发性或难治性急性淋巴细胞白血病儿童和成人患者的治疗。
EGFRvIII表达于大约30%的新诊GBM患者;然而,在存活一年或更长时间的患者中,EGFRvIII的表达被认为与较差的预后相关。此次报道的试点研究中,将CART-EGFRvIII疗法用于10例过度治疗的复发性/难治性GBM患者,每例患者接受了单剂量静脉输注CAR-T细胞。其中,3例患者在输注CAR-T后未接受手术治疗;3例患者在输注后的34、55、105天接受了手术;4例早期接受手术治疗并表现出明确症状恶化的患者,接受了CAR-T并联合进行了临床适应的手术。
对接受了CAR-T输注且不久后开展了手术的患者肿瘤样本进行检测发现,在输注CAR-T后的前2周内在肿瘤样本中发现了CART-EGFRvIII细胞和激活迹象。同时,在输注CAR-T的全部患者的血液中也发现了循环CAR-T细胞。血液中CART-EGFRvIII细胞水平在2周后开始下降,在一个月后检测不到。来自5例接受CAR-T后开展了手术的患者肿瘤样本中也表现出了更低水平的目标抗原EGFRvIII。
值得一提的是,这项I期临床研究的主要终点是安全性,而不是疗效,因此不大可能识别CART-EGFRvIII疗法的明确临床疗效。然而,有一例患者在随访18个月时病情仍保持稳定,并且在研究数据公布时仍然健在。另2例患者也健在,但表现出病情进展;其余7例患者的生存时间比根据其治疗史和多灶性肿瘤复发所预测的生存时间均表现出稳步延长。
该研究表明治疗与脑内的“on-target”活性相关,同时还发现,EGFRvIII表达在患者中随时间推移以及在不同的肿瘤区域存在着非常大的变化。此外,CAR-T疗法也触发了免疫抑制调节性T细胞的产生,这些T细胞迁移进入肿瘤,导致了额外的免疫抑制性通路的上调。作者指出,EGFRvIII的多变性和肿瘤微环境中的抑制性反应,将代表着CAR-T疗法临床应用的潜在障碍。
研究人员在论文中写道,尽管前者意味着将需要靶向额外的抗原,但后者却可能利用靶向免疫抑制分子的现有药物进行克服。CAR-T细胞治疗复发性GBM的初步经验表明,尽管静脉输注导致了脑内的on-target效应,但克服肿瘤局部微环境中的适应性变化和解决抗原异质性将可能提高EGFRvIII靶向策略在GBM治疗中的疗效。
该研究的领导者、宾夕法尼亚大学佩雷尔曼医学院神经外科副教授DonaldM.O’Rourke表示,输注CAR-T细胞后,在肿瘤中观察到了抑制性T细胞的急剧扩张,比没有输注CAR-T细胞的情况下显著多得多。这告诉我们,需要开始调节微环境使之更有利。将CAR-T细胞与抑制这些通路的小分子药物或检查点抑制剂进行联合用药可能具有协同作用。
尽管GBM的免疫抑制性是公认的,但这项研究中适应性环境是一个新的发现。该研究代表着对GBM肿瘤微环境的深度初探,我们最终将获得关于CAR-T细胞输注前后肿瘤微环境变化的一些线索,并可能开始制定方法来改变这一局面,打破这种平衡使之更有利于临床疗效。
O'Rourke教授强调,关于本研究,令人兴奋的事情之一是输注CAR-T细胞后进入大脑的T细胞克隆数量。如果我们能制定出相关策略使更多的T细胞进入大脑,并结合肿瘤微环境修饰疗法,我们可能会获得更好的临床结果。其中一种可能将CAR-T疗法和免疫检查点抑制剂联合应用,例如PD-1或PD-L1抑制剂。目前宾夕法尼亚大学的一些研究小组正在临床前模型和患者中积极开展GBM肿瘤微环境研究。
安全性是CAR-T疗法应用于临床所面临的一个潜在问题,但在该研究中并不突出。O'Rourke教授强调,研究开始的时候研究人员所关心的是这种高活性产品会造成大量的脑部炎症。但事实上,却没有看到任何临床不良问题,这些早期的安全性迹象非常令人鼓舞。去年,Juno公司的JCAR015CAR-T疗法爆出重大安全问题,并导致患者死亡。今年早些时候,Juno证实,该公司已放弃JCAR015治疗复发性或难治性ALL的进一步临床开发。
诺华与宾夕法尼亚大学于2012年签署全球合作和授权协议,研究、开发、商业化CAR-T疗法用于癌症的治疗。EGFRvIIICAR-T疗法诞生于该合作,根据协议,诺华将拥有该疗法的独家权利。诺华发言人表示,该公司正在考虑组合策略,来增强EGFRvIII靶向性CAR-T疗法针对GBM肿瘤的疗效。
目前,诺华和宾夕法尼亚大学正在合作开发多个CAR-T候选药物,包括:CTL119,这是一种人源化抗CD19CAR疗法,目前处于初步临床开发用于多种B细胞恶性肿瘤的治疗;CART-BCMA,这是一种新颖的全人源化CAR疗法,靶向B细胞成熟抗原,目前正调查治疗多发性骨髓瘤的潜力;另有一种新型全人源化抗间皮素CAR疗法,近日启动了实体瘤的临床试验。