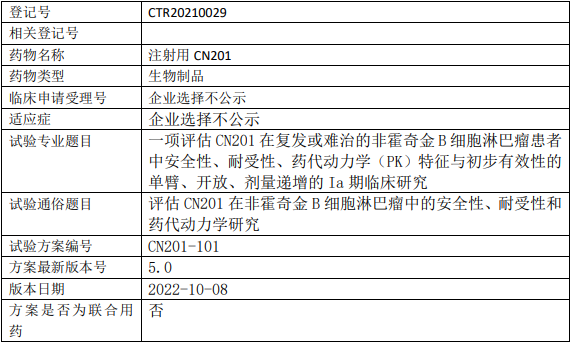
同润生物CN201临床试验,评估注射用CN201治疗复发或难治的非霍奇金B细胞淋巴瘤安全性、耐受性、药代动力学(PK)特征与初步有效性的Ia期临床试验
试验目的
1.确定在复发或难治的B-NHL患者中给予CN201的安全性和耐受性、剂量限制性毒性(DLT)、最大耐受剂量(MTD)和/或II期推荐剂量(RP2D);
2.初步观察CN201在复发或难治的B-NHL患者中的抗肿瘤疗效;
3.评估CN201在复发或难治的B-NHL患者中的免疫原性。
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄≥18周岁,≤75周岁,性别不限;
2、复发或难治的B-NHL患者。须符合病理免疫组化CD19阳性的下述世界卫生组织(WHO)的B-NHL诊断亚型:弥漫性大B细胞淋巴瘤(DLBCL)、滤泡性淋巴瘤(FL)(I~III级)、边缘区淋巴瘤、淋巴浆细胞淋巴瘤、套细胞淋巴瘤、小淋巴细胞性淋巴瘤、转化型大B细胞淋巴瘤;
3、根据Lugano2014标准,至少有一个可评估的肿瘤病灶,即根据计算机断层扫描(CT)横断面影像淋巴结病灶长径15mm,或结节外病灶长径10mm;
4、美国东部肿瘤协作组(ECOG)体力评分≤2分,并且预计生存时间3个月以上的患者;
5、骨髓功能基本正常的患者,包括:PLT≥75×10^9/L,中性粒细胞绝对计数(ANC)≥1.5×10^9/L,外周血淋巴细胞绝对计数(ALC)≥200/μL,血红蛋白(Hgb)≥9.0g/dL;
6、凝血功能基本正常的患者:活化部分凝血活酶时间(APTT)≤1.5×正常值上限(ULN);国际标准化比值(INR)≤1.5×ULN;
7、肝、肾、肺、心脏功能基本正常的患者:
(a)肝功能:血清总胆红素≤1.5×ULN(除非有证据表明患者患有Gilbert综合征,则≤3.0×ULN);谷草转氨酶(AST)和谷丙转氨酶(ALT)≤2.5×ULN;(如果有肿瘤继发性改变影响到肝脏,则≤5.0×ULN);
(b)血清肌酐≤1.5×ULN或估计肌酐清除率≥50mL/min(按实际测量中心的计算标准);
(c)超声心动检查:左室射血分数(LVEF)≥50%,无心包积液;12导联心电图(ECG)结果:无临床显著的ECG异常[任何级别的房颤、II度II型房室传导阻滞或III度房室传导阻滞或QTcF470msec(女性)或450msec(男性);其他未得到控制的症状性心律失常];
(d)无显著临床意义的胸腔积液;
(e)血氧饱和度92%(非吸氧状态下)。
8、患者须在试验前对本研究知情同意,并自愿签署书面的ICF。
9、育龄期女性患者在首次使用试验用药品前7天内的血或尿妊娠试验必须为阴性;有生育能力的患者(男性和女性)必须同意自签署ICF至末次用药后90天内与其伴侣一起使用可靠的避孕方法(激素或屏障法或禁欲)。
排除标准
1、在首次使用试验用药品前4周内接受过化疗、小分子靶向药物、内分泌治疗、或其他抗肿瘤药物治疗的患者;
2、在首次使用试验用药品前4周内,或药物的5个半衰期内(以时间长的为准)接受过抗肿瘤免疫治疗或其他未上市的临床试验用药品的患者(本研究2.5μg/次、5μg/次剂量组的受试者在停止本试验用药治疗后,经研究者判定受试者可能在高剂量组有受益,遵从患者意愿,经申办者同意,经药物的5个半衰期洗脱后,允许一次机会参加较高剂量组用药)。
3、在首次使用试验用药品前4周内接受过主要脏器外科手术(不包括穿刺活检)或出现过显著外伤,或需要在试验期间接受择期手术的患者;
4、在首次使用试验用药品前4周内使用过减毒活疫苗的患者;
5、伴有中枢神经系统(CNS)浸润的患者;
6、既往或伴有CNS疾病的患者,包括:癫痫、出血性/缺血性脑卒中、严重脑损伤、痴呆、帕金森病、小脑疾病、器质性脑综合征、精神疾病等;
7、既往或伴有其他恶性肿瘤(已治愈的皮肤基底细胞或者鳞状细胞癌、宫颈原位癌、前列腺上皮内瘤除外)的患者;
8、有活动性感染,且目前需要系统性抗感染治疗的患者;
9、有活动性乙型肝炎和/或丙型肝炎的患者;
10、有免疫缺陷病史的患者;
11、目前或曾患有间质性肺病的患者;
12、曾接受免疫治疗并出现≥3级免疫相关不良事件的患者;
13、研究者认为患者存在其他原因而不适合参加本临床研究。
疾病控制率76.2%!肺癌重磅新药AMG510,治疗结直肠癌同样有效!
研究的主要作者,来自伊丽莎白女王医院及阿德莱德大学的TimothyJayPrice教授指出,研究所纳入的患者均为曾经接受过治疗的患者,其中结直肠癌亚组患者数量最多,AMG510已经展现出了不错的疗效,大部分患者实现了疾病控制,因此与目前的标准护理模式相比,这部分患者取得了更长的无进展生存期。在这项最早公开于2020年ESMO大会亚洲分会上的研究数据中显示,治疗42例KRASG12C突变型结直肠癌(大肠癌)患者,缓解率7.1%,疾病控制率达到了76.2%。早在2019年时,研究者曾经公开了首款正式走入临床的
0评论2026-01-221
重磅来袭!2020年FDA获批实体瘤药物年度汇总——靶向篇
2获批药物:Tucatinib靶点:HER2临床试验:HER2CLIMBtrial伴随诊断:——获批时间:2020.4.17获批适应症:联合曲妥珠单抗和卡培他滨批准用于治疗晚期不可切除或转移性HER2阳性的乳腺癌成人患者,包括脑转移患者,且既往已接受一或多个抗HER2的治疗方案。胆管癌1获批药物:Pemigatinib靶点:FGFR2临床试验:FIGHT-202伴随诊断:FoundationOne®CDX(FoundationMedicine,Inc.)获批时间:2020.4.17获批适应症:用于治疗先前
0评论2026-01-2210
病理确诊结果出具前,医师不得开抗肿瘤药物
办法提出,开展肿瘤诊疗服务的二级以上医疗机构,应当在药事管理与药物治疗学委员会下设立抗肿瘤药物管理工作组,并定期对本机构抗肿瘤药物相关的医师、药师、护士进行抗肿瘤药物临床应用知识培训并进行考核。第二十条二级以上医疗机构应当定期对本机构抗肿瘤药物相关的医师、药师、护士进行抗肿瘤药物临床应用知识培训并进行考核。第三章抗肿瘤药物临床应用管理第十五条医疗机构应当严格执行《药品管理法》及其实施条例、《处方管理办法》《医疗机构药事管理规定》《医疗机构处方审核规范》等相关规定及技术规范,加强抗肿瘤药物遴选、采购、储存、
0评论2026-01-221
患了晚期恶性实体瘤后无药可用?多款国产新药新技术重拳出击!
高效抗脑转靶向药恩曲替尼势不可挡2019年8月,FDA加速批准了全球第三款广谱“治愈系”抗癌药Entrectinib(Rozlytrek,恩曲替尼,RXDX-101)上市,用于治疗成人和儿童患者神经营养原肌球蛋白受体激酶(NTRK)融合阳性、初始治疗后局部晚期或转移性实体肿瘤进展或无标准治疗方案的实体瘤患者,以及ROS1阳性非小细胞肺癌(NSCLC)患者。首个实体瘤细胞免疫疗法获FDA突破性疗法称号2019年6月,FDA批准肿瘤浸润淋巴细胞(TIL)治疗方法LN-145为突破性的治疗指定,这是用于实体瘤的
0评论2026-01-221
2021最新肺癌NCCN指南出炉!靶向新药层出不穷,强势逆转生存期!
ROS1:曲替尼成为ROS1一二线脑转移优先推荐,效抗脑转2019年8月,FDA加速批准了全球第三款广谱“治愈系”抗癌药Entrectinib(Rozlytrek,恩曲替尼,RXDX-101)上市,用于治疗成人和儿童患者神经营养原肌球蛋白受体激酶(NTRK)融合阳性、初始治疗后局部晚期或转移性实体肿瘤进展或无标准治疗方案的实体瘤患者,以及ROS1阳性非小细胞肺癌(NSCLC)患者。PD-1高表达晚期NSCLC,药成为一线优先推荐,+Y双免推荐级别升至1级对于PD-L1高表达的晚期非小细胞肺癌患者,无论是鳞
0评论2026-01-1958
第四代EGFR抑制剂来了!奥希替尼耐药不用怕,六大处理方案全梳理!
一肺腺癌女性62岁患者,先后进行了化疗、吉非替尼、厄洛替尼耐药后,出现T790M突变用奥希替尼治疗。SYMPHONY研究是BLU-945的首次人体1/2期开放性标签临床试验,旨在评估BLU-945单药和联合奥希替尼治疗对EGFR-TKI耐药的晚期NSCLC患者的安全性、耐受性和有效性。四、新靶点药或“四代”TKI1.U3-14022020WCLC报告了一项I期临床研究,评估晚期EGFR突变NSCLC患者在EGFR-TKIs奥希替尼治疗和铂类化疗失败后使用HER3抑制剂U3-1402(patritumab-
0评论2026-01-19130
12月6款创新药有望被FDA批准
2.药物名称:特瑞普利单抗公司名称:君实生物/CoherusBioSciences适应症:鼻咽癌Toripalimab是一种抗PD-1单克隆抗体,能特异性结合T细胞表面的PD-1分子,从而阻断导致肿瘤免疫耐受的PD-1/PD-L1通路,重新激活淋巴细胞的抗肿瘤活性,达到治疗癌症的目的。NewDrugApplicationforAdagrasibasTreatmentofPreviouslyTreatedKRASG12C-MutatedNon-SmallCellLungCancer.RetrievedNov
0评论2026-01-1938
又一款“广谱抗癌”潜力新药获突破性指定!HER2靶点新药迈出临床第一步!
Ⅰ期临床试验结果抢先看:多癌种抗癌潜力,疾病稳定率最高66.7%Zanidatamab的Ⅰ期临床试验中纳入了多种实体瘤的患者,包括胆管癌、胃食管交界处癌和结直肠癌等,所有患者平均接受过3线治疗方案,其中约59%的患者曾接受过前线HER2治疗(曲妥珠单抗)。该指定基于一项正在进行的Ⅰ期临床试验,使用Zanidatamab治疗多种曾经接受过治疗的不可切除的局部晚期和/或转移性HER2阳性实体瘤患者。就在今天,加拿大癌症生物疗法公司ZymeworksInc.宣布,FDA授予其研发的靶向HER2的双特异性抗体药物
0评论2026-01-1931
一至四代EGFR靶向药物大汇总
图五吉非替尼、奥希替尼、BLU-701、BLU-945对不同EGFR突变的IC50,绿色为强抑制,黄色中等抑制,紫色为弱或无抑制2022年的AACR大会报道了BLU-945的I期临床研究,剂量递增阶段33例患者的数据,这些患者先前接受过超过1种EGFR靶向药治疗,97%接受过奥希替尼治疗,64%有脑转移,55%为亚裔。一项来自中国的很小型的回顾性研究,纳入6例基线无症状脑转移EGFR突变患者,全部为非鳞癌,接受30mg达可替尼治疗,在5例疗效可评估患者中,2例脑转移完全缓解,3例脑转移稳定,颅内客观缓解率
0评论2026-01-1938

