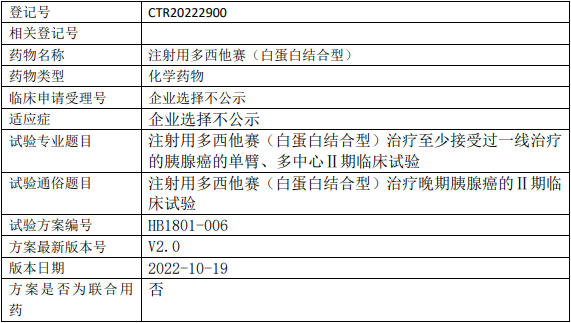
石药集团中奇制药多西他赛临床试验,注射用多西他赛(白蛋白结合型)注射液治疗至少接受过一线治疗的胰腺癌单臂、多中心的Ⅱ期临床试验
试验目的
主要目的
评价注射用多西他赛(白蛋白结合型)在至少接受过一线治疗的胰腺癌受试者中的经确认的客观缓解率(ORR,由独立审评委员会(IRC)依据实体瘤疗效反应的评价标准(RECIST)1.1版评估)。
次要目的
1、评价注射用多西他赛(白蛋白结合型)在至少接受过一线治疗的胰腺癌受试者中的经确认的ORR(研究者依据RECIST1.1标准评估)、总生存期(OS)、以及IRC和研究者依据RECIST1.1标准评估的无进展生存期(PFS)、疾病控制率(DCR)和缓解持续时间(DoR);
2、评价注射用多西他赛(白蛋白结合型)在至少接受过一线治疗的胰腺癌受试者中的安全性;
3、评价注射用多西他赛(白蛋白结合型)在至少接受过一线治疗的胰腺癌受试者中的安全性。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄大于等于18周岁(以签署知情同意书当天为准)且自愿签署知情同意书者;
2、经组织学或细胞学确诊的胰腺腺癌;
3既往经标准治疗(含吉西他滨和含氟尿嘧啶类的方案)后疾病进展或毒性不耐受;
4、基线至少有一个符合RECIST1.1标准的可测量病灶(可测量病灶区域既往未接受过放疗,或者有证据表明该病灶在放疗结束后明确进展);
5、ECOGPS评分0~2分;
6、预计生存期≥3个月;
7、良好的器官功能(进行相关检查采血前2周内没有接受过输血或生长因子支持治疗),包括:
●中性粒细胞绝对计数(ANC)≥1.5×109/L;
●血红蛋白(Hb)≥90g/L;
●血小板≥100×109/L;
●白蛋白≥30g/L;
●肌酐≤1.5×ULN或肌酐清除率≥40mL/min;
●总胆红素≤1.5×ULN(梗阻性黄疸引流者可≤2×ULN;
●Gilbert’s综合征者可≤3×ULN);
●丙氨酸氨基转移酶(AST)和天冬氨酸氨基转移酶(ALT)≤3×ULN(肝转移受试者≤5倍正常值上限);
●凝血酶原时间(PT)≤1.5×ULN,国际标准化比率≤1.5×ULN。
8、受试者必须同意从签署知情同意书开始至末次给药后6个月内采取有效的避孕措施,育龄女性(WOCBP)在首次使用试验用药品前7天内的血清妊娠试验为阴性。
排除标准
1、对试验用药品的任何辅料或紫杉烷类药物有严重过敏史者;
2、既往紫杉类药物治疗无效(未观察到肿瘤缩小或开始治疗后3月内疾病进展);
3、经积极治疗无法缓解的部分或完全性肠梗阻、完全性胆道梗阻的受试者;
4、首次使用试验用药品前2年内存在过活动性恶性肿瘤,除外本试验中研究的胰腺癌以及任何已经接受过根治性治疗的局部可治愈的肿瘤(例如已切除的基底细胞或鳞状细胞皮肤癌、浅表性膀胱癌、宫颈或乳腺原位癌等);
5、脑转移和脑膜转移受试者;
6、慢性乙型肝炎(HBsAg和/或HBcAb阳性但HBVDNA2000IU/mL可以纳入)、慢性丙型肝炎(HCV抗体阳性但HCVRNA阴性可以纳入)、HIV抗体阳性的受试者;
7、既往抗肿瘤治疗毒性未恢复至≤1级(脱发、色素沉着或研究者认为对受试者无安全性风险的其他毒性除外);
8、有严重的心血管疾病史,包括但不限于:
a).首次使用试验用药品前6个月内有严重的心脏节律或传导异常,包括但不限于需要临床干预的室性心律失常、Ш度房室传导阻滞等;
b).首次使用试验用药品前6个月内有心肌梗塞、心绞痛、血管成形术、冠状动脉搭桥外科病史;
c).心力衰竭,纽约心脏病学会(NYHA)分级为Ш级及以上;
d).控制不良的高血压(筛选期收缩压≥160mmHg和/或舒张压≥100mmHg)。
9、首次使用试验用药品前7天内,存在不能控制的需要频繁引流或医疗干预的浆膜腔积液(如胸腔积液、腹腔积液、心包积液等,需要在干预后2周内进行额外干预,不包括对渗出液行脱落细胞学检测);
10、首次使用试验用药品前14天内,需要进行系统性抗细菌、抗真菌或抗病毒治疗的严重或活动性感染(包括结核菌感染等),允许病毒性肝炎受试者接受抗病毒治疗;
11、在首次给药前4周或5个半衰期内(以时间短者为准)接受过任何抗肿瘤治疗(包括化疗、靶向治疗、免疫治疗等)以及任何临床研究治疗;
12、在首次使用试验用药品前2周内使用过CYP3A4的强效抑制剂或强效诱导剂;
13、在首次给药前4周内接受过重大手术且尚未充分恢复,或者计划在研究期间进行重大手术者;
14、妊娠或哺乳期妇女;
15、同时参与另一项临床研究,除非为观察性(非干预性)临床研究或处于干预性研究的随访期;
16、其他研究者认为不适合参加临床试验的情况,包括但不限于:受试者并发严重或无法控制的医学病症,存在安全性风险,干扰研究结果的解读,影响试验依从性等情况。
疾病控制率76.2%!肺癌重磅新药AMG510,治疗结直肠癌同样有效!
研究的主要作者,来自伊丽莎白女王医院及阿德莱德大学的TimothyJayPrice教授指出,研究所纳入的患者均为曾经接受过治疗的患者,其中结直肠癌亚组患者数量最多,AMG510已经展现出了不错的疗效,大部分患者实现了疾病控制,因此与目前的标准护理模式相比,这部分患者取得了更长的无进展生存期。在这项最早公开于2020年ESMO大会亚洲分会上的研究数据中显示,治疗42例KRASG12C突变型结直肠癌(大肠癌)患者,缓解率7.1%,疾病控制率达到了76.2%。早在2019年时,研究者曾经公开了首款正式走入临床的
0评论2026-01-221
重磅来袭!2020年FDA获批实体瘤药物年度汇总——靶向篇
2获批药物:Tucatinib靶点:HER2临床试验:HER2CLIMBtrial伴随诊断:——获批时间:2020.4.17获批适应症:联合曲妥珠单抗和卡培他滨批准用于治疗晚期不可切除或转移性HER2阳性的乳腺癌成人患者,包括脑转移患者,且既往已接受一或多个抗HER2的治疗方案。胆管癌1获批药物:Pemigatinib靶点:FGFR2临床试验:FIGHT-202伴随诊断:FoundationOne®CDX(FoundationMedicine,Inc.)获批时间:2020.4.17获批适应症:用于治疗先前
0评论2026-01-2210
病理确诊结果出具前,医师不得开抗肿瘤药物
办法提出,开展肿瘤诊疗服务的二级以上医疗机构,应当在药事管理与药物治疗学委员会下设立抗肿瘤药物管理工作组,并定期对本机构抗肿瘤药物相关的医师、药师、护士进行抗肿瘤药物临床应用知识培训并进行考核。第二十条二级以上医疗机构应当定期对本机构抗肿瘤药物相关的医师、药师、护士进行抗肿瘤药物临床应用知识培训并进行考核。第三章抗肿瘤药物临床应用管理第十五条医疗机构应当严格执行《药品管理法》及其实施条例、《处方管理办法》《医疗机构药事管理规定》《医疗机构处方审核规范》等相关规定及技术规范,加强抗肿瘤药物遴选、采购、储存、
0评论2026-01-221
患了晚期恶性实体瘤后无药可用?多款国产新药新技术重拳出击!
高效抗脑转靶向药恩曲替尼势不可挡2019年8月,FDA加速批准了全球第三款广谱“治愈系”抗癌药Entrectinib(Rozlytrek,恩曲替尼,RXDX-101)上市,用于治疗成人和儿童患者神经营养原肌球蛋白受体激酶(NTRK)融合阳性、初始治疗后局部晚期或转移性实体肿瘤进展或无标准治疗方案的实体瘤患者,以及ROS1阳性非小细胞肺癌(NSCLC)患者。首个实体瘤细胞免疫疗法获FDA突破性疗法称号2019年6月,FDA批准肿瘤浸润淋巴细胞(TIL)治疗方法LN-145为突破性的治疗指定,这是用于实体瘤的
0评论2026-01-221
2021最新肺癌NCCN指南出炉!靶向新药层出不穷,强势逆转生存期!
ROS1:曲替尼成为ROS1一二线脑转移优先推荐,效抗脑转2019年8月,FDA加速批准了全球第三款广谱“治愈系”抗癌药Entrectinib(Rozlytrek,恩曲替尼,RXDX-101)上市,用于治疗成人和儿童患者神经营养原肌球蛋白受体激酶(NTRK)融合阳性、初始治疗后局部晚期或转移性实体肿瘤进展或无标准治疗方案的实体瘤患者,以及ROS1阳性非小细胞肺癌(NSCLC)患者。PD-1高表达晚期NSCLC,药成为一线优先推荐,+Y双免推荐级别升至1级对于PD-L1高表达的晚期非小细胞肺癌患者,无论是鳞
0评论2026-01-1958
第四代EGFR抑制剂来了!奥希替尼耐药不用怕,六大处理方案全梳理!
一肺腺癌女性62岁患者,先后进行了化疗、吉非替尼、厄洛替尼耐药后,出现T790M突变用奥希替尼治疗。SYMPHONY研究是BLU-945的首次人体1/2期开放性标签临床试验,旨在评估BLU-945单药和联合奥希替尼治疗对EGFR-TKI耐药的晚期NSCLC患者的安全性、耐受性和有效性。四、新靶点药或“四代”TKI1.U3-14022020WCLC报告了一项I期临床研究,评估晚期EGFR突变NSCLC患者在EGFR-TKIs奥希替尼治疗和铂类化疗失败后使用HER3抑制剂U3-1402(patritumab-
0评论2026-01-19130
12月6款创新药有望被FDA批准
2.药物名称:特瑞普利单抗公司名称:君实生物/CoherusBioSciences适应症:鼻咽癌Toripalimab是一种抗PD-1单克隆抗体,能特异性结合T细胞表面的PD-1分子,从而阻断导致肿瘤免疫耐受的PD-1/PD-L1通路,重新激活淋巴细胞的抗肿瘤活性,达到治疗癌症的目的。NewDrugApplicationforAdagrasibasTreatmentofPreviouslyTreatedKRASG12C-MutatedNon-SmallCellLungCancer.RetrievedNov
0评论2026-01-1937
又一款“广谱抗癌”潜力新药获突破性指定!HER2靶点新药迈出临床第一步!
Ⅰ期临床试验结果抢先看:多癌种抗癌潜力,疾病稳定率最高66.7%Zanidatamab的Ⅰ期临床试验中纳入了多种实体瘤的患者,包括胆管癌、胃食管交界处癌和结直肠癌等,所有患者平均接受过3线治疗方案,其中约59%的患者曾接受过前线HER2治疗(曲妥珠单抗)。该指定基于一项正在进行的Ⅰ期临床试验,使用Zanidatamab治疗多种曾经接受过治疗的不可切除的局部晚期和/或转移性HER2阳性实体瘤患者。就在今天,加拿大癌症生物疗法公司ZymeworksInc.宣布,FDA授予其研发的靶向HER2的双特异性抗体药物
0评论2026-01-1930
一至四代EGFR靶向药物大汇总
图五吉非替尼、奥希替尼、BLU-701、BLU-945对不同EGFR突变的IC50,绿色为强抑制,黄色中等抑制,紫色为弱或无抑制2022年的AACR大会报道了BLU-945的I期临床研究,剂量递增阶段33例患者的数据,这些患者先前接受过超过1种EGFR靶向药治疗,97%接受过奥希替尼治疗,64%有脑转移,55%为亚裔。一项来自中国的很小型的回顾性研究,纳入6例基线无症状脑转移EGFR突变患者,全部为非鳞癌,接受30mg达可替尼治疗,在5例疗效可评估患者中,2例脑转移完全缓解,3例脑转移稳定,颅内客观缓解率
0评论2026-01-1938

