礼新医药LM-302临床试验,评价LM-302注射液治疗CLDN18.2阳性的晚期实体瘤安全性、耐受性、药代动力学、免疫原性和抗肿瘤活性的I/II期临床试验
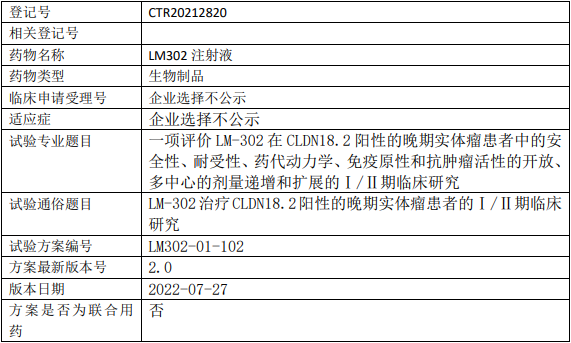
试验目的
I期剂量递增阶段主要目的
评估LM-302在CLDN18.2阳性的晚期实体瘤患者中的安全性和耐受性、确定最大耐受剂量(MTD)和探索II期推荐剂量(RP2D)。
Ⅱ期剂量扩展阶段主要目的
评价LM-302在CLDN18.2阳性的晚期胃癌/胃食管连接部癌(GC/GEJ)、胰腺癌(PC)和胆道癌(BTC)患者中的抗肿瘤活性。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至80岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、患者充分了解试验目的、性质、方法及可能发生的不良反应,自愿作为参与者,并在任何程序开始前签署知情同意书(ICF)。
2、签署ICF时年龄18-80周岁(包括边界值)的患者,性别不限。
3、东部肿瘤合作组织(ECOG)标准,体能状态为0-1分。
4、预期生存期≥3个月。
5、经组织学和/或细胞学确诊的且既往标准治疗失败、或缺乏标准治疗方案、或不耐受标准治疗、或现阶段不适用标准治疗的晚期实体瘤患者。
6、中心实验室采用免疫组织化学(IHC)方法检测为CLDN18.2阳性的受试者。
7、根据RECISTv1.1标准,I期剂量递增阶段至少有1个可评估(包括可测量及不可测量)的病灶、II期剂量扩展阶段至少有1个可测量的病灶。
8、首次给药前7天内,具备适当的骨髓储备和器官功能。
9、能够和研究者进行良好的沟通,并且理解和遵守本项研究的各项要求。
排除标准
1、在首次给药前28天内接受过其它未上市的临床研究药物或治疗。
2、首次给药前21天内接受过化疗、放疗、生物治疗、内分泌治疗、免疫治疗等抗肿瘤治疗者。
3、目前存在的外周感觉或运动神经病变≥2级。
4、已知有脑转移的患者。经研究者判断为稳定性脑转移者可入组。
5、临床无法控制的第三间隙积液,经研究者判断不适合入组。
6、已知既往对抗体类药物≥3级过敏者。
7、有严重的心脑血管疾病史者,包括但不限于:
1)有严重的心脏节律或传导异常,如需要临床干预的室性心律失常、II-III度房室传导阻滞等;
2)需要治疗性抗凝的血栓栓塞事件,或具有静脉滤器的受试者;
3)按美国纽约心脏病协会(NYHA)标准,III~IV级心功能不全者;
4)首次给药前6个月内发生急性冠脉综合征、充血性心力衰竭、主动脉夹层、脑卒中或其他3级及以上心脑血管事件;
5)临床无法控制的高血压。
8、无法控制或有严重疾病者,包括但不限于需要系统性抗生素治疗的活动性感染。
9、既往免疫缺陷病史者,包括患有其他获得性、先天性免疫缺陷疾病,或有器官移植史,或有异基因骨髓移植史,或自体造血干细胞移植。
10、HIV感染,活动性HBV或HCV感染者。
11、研究者判断不适于参与此研究的其他情况。
12、既往抗肿瘤治疗的不良反应尚未恢复到CTCAEv5.0等级评价≤1级者。
13、在首次给药前2年内有除本研究肿瘤以外的恶性肿瘤史者,以下肿瘤疾病除外:皮肤基底细胞癌、宫颈原位癌、乳腺原位癌、皮肤鳞状上皮细胞癌经治疗已经得到控制者。
疾病控制率76.2%!肺癌重磅新药AMG510,治疗结直肠癌同样有效!
研究的主要作者,来自伊丽莎白女王医院及阿德莱德大学的TimothyJayPrice教授指出,研究所纳入的患者均为曾经接受过治疗的患者,其中结直肠癌亚组患者数量最多,AMG510已经展现出了不错的疗效,大部分患者实现了疾病控制,因此与目前的标准护理模式相比,这部分患者取得了更长的无进展生存期。在这项最早公开于2020年ESMO大会亚洲分会上的研究数据中显示,治疗42例KRASG12C突变型结直肠癌(大肠癌)患者,缓解率7.1%,疾病控制率达到了76.2%。早在2019年时,研究者曾经公开了首款正式走入临床的
0评论2026-01-221
重磅来袭!2020年FDA获批实体瘤药物年度汇总——靶向篇
2获批药物:Tucatinib靶点:HER2临床试验:HER2CLIMBtrial伴随诊断:——获批时间:2020.4.17获批适应症:联合曲妥珠单抗和卡培他滨批准用于治疗晚期不可切除或转移性HER2阳性的乳腺癌成人患者,包括脑转移患者,且既往已接受一或多个抗HER2的治疗方案。胆管癌1获批药物:Pemigatinib靶点:FGFR2临床试验:FIGHT-202伴随诊断:FoundationOne®CDX(FoundationMedicine,Inc.)获批时间:2020.4.17获批适应症:用于治疗先前
0评论2026-01-2210
病理确诊结果出具前,医师不得开抗肿瘤药物
办法提出,开展肿瘤诊疗服务的二级以上医疗机构,应当在药事管理与药物治疗学委员会下设立抗肿瘤药物管理工作组,并定期对本机构抗肿瘤药物相关的医师、药师、护士进行抗肿瘤药物临床应用知识培训并进行考核。第二十条二级以上医疗机构应当定期对本机构抗肿瘤药物相关的医师、药师、护士进行抗肿瘤药物临床应用知识培训并进行考核。第三章抗肿瘤药物临床应用管理第十五条医疗机构应当严格执行《药品管理法》及其实施条例、《处方管理办法》《医疗机构药事管理规定》《医疗机构处方审核规范》等相关规定及技术规范,加强抗肿瘤药物遴选、采购、储存、
0评论2026-01-221
患了晚期恶性实体瘤后无药可用?多款国产新药新技术重拳出击!
高效抗脑转靶向药恩曲替尼势不可挡2019年8月,FDA加速批准了全球第三款广谱“治愈系”抗癌药Entrectinib(Rozlytrek,恩曲替尼,RXDX-101)上市,用于治疗成人和儿童患者神经营养原肌球蛋白受体激酶(NTRK)融合阳性、初始治疗后局部晚期或转移性实体肿瘤进展或无标准治疗方案的实体瘤患者,以及ROS1阳性非小细胞肺癌(NSCLC)患者。首个实体瘤细胞免疫疗法获FDA突破性疗法称号2019年6月,FDA批准肿瘤浸润淋巴细胞(TIL)治疗方法LN-145为突破性的治疗指定,这是用于实体瘤的
0评论2026-01-221
2021最新肺癌NCCN指南出炉!靶向新药层出不穷,强势逆转生存期!
ROS1:曲替尼成为ROS1一二线脑转移优先推荐,效抗脑转2019年8月,FDA加速批准了全球第三款广谱“治愈系”抗癌药Entrectinib(Rozlytrek,恩曲替尼,RXDX-101)上市,用于治疗成人和儿童患者神经营养原肌球蛋白受体激酶(NTRK)融合阳性、初始治疗后局部晚期或转移性实体肿瘤进展或无标准治疗方案的实体瘤患者,以及ROS1阳性非小细胞肺癌(NSCLC)患者。PD-1高表达晚期NSCLC,药成为一线优先推荐,+Y双免推荐级别升至1级对于PD-L1高表达的晚期非小细胞肺癌患者,无论是鳞
0评论2026-01-1958
第四代EGFR抑制剂来了!奥希替尼耐药不用怕,六大处理方案全梳理!
一肺腺癌女性62岁患者,先后进行了化疗、吉非替尼、厄洛替尼耐药后,出现T790M突变用奥希替尼治疗。SYMPHONY研究是BLU-945的首次人体1/2期开放性标签临床试验,旨在评估BLU-945单药和联合奥希替尼治疗对EGFR-TKI耐药的晚期NSCLC患者的安全性、耐受性和有效性。四、新靶点药或“四代”TKI1.U3-14022020WCLC报告了一项I期临床研究,评估晚期EGFR突变NSCLC患者在EGFR-TKIs奥希替尼治疗和铂类化疗失败后使用HER3抑制剂U3-1402(patritumab-
0评论2026-01-19130
12月6款创新药有望被FDA批准
2.药物名称:特瑞普利单抗公司名称:君实生物/CoherusBioSciences适应症:鼻咽癌Toripalimab是一种抗PD-1单克隆抗体,能特异性结合T细胞表面的PD-1分子,从而阻断导致肿瘤免疫耐受的PD-1/PD-L1通路,重新激活淋巴细胞的抗肿瘤活性,达到治疗癌症的目的。NewDrugApplicationforAdagrasibasTreatmentofPreviouslyTreatedKRASG12C-MutatedNon-SmallCellLungCancer.RetrievedNov
0评论2026-01-1937
又一款“广谱抗癌”潜力新药获突破性指定!HER2靶点新药迈出临床第一步!
Ⅰ期临床试验结果抢先看:多癌种抗癌潜力,疾病稳定率最高66.7%Zanidatamab的Ⅰ期临床试验中纳入了多种实体瘤的患者,包括胆管癌、胃食管交界处癌和结直肠癌等,所有患者平均接受过3线治疗方案,其中约59%的患者曾接受过前线HER2治疗(曲妥珠单抗)。该指定基于一项正在进行的Ⅰ期临床试验,使用Zanidatamab治疗多种曾经接受过治疗的不可切除的局部晚期和/或转移性HER2阳性实体瘤患者。就在今天,加拿大癌症生物疗法公司ZymeworksInc.宣布,FDA授予其研发的靶向HER2的双特异性抗体药物
0评论2026-01-1930
一至四代EGFR靶向药物大汇总
图五吉非替尼、奥希替尼、BLU-701、BLU-945对不同EGFR突变的IC50,绿色为强抑制,黄色中等抑制,紫色为弱或无抑制2022年的AACR大会报道了BLU-945的I期临床研究,剂量递增阶段33例患者的数据,这些患者先前接受过超过1种EGFR靶向药治疗,97%接受过奥希替尼治疗,64%有脑转移,55%为亚裔。一项来自中国的很小型的回顾性研究,纳入6例基线无症状脑转移EGFR突变患者,全部为非鳞癌,接受30mg达可替尼治疗,在5例疗效可评估患者中,2例脑转移完全缓解,3例脑转移稳定,颅内客观缓解率
0评论2026-01-1938

