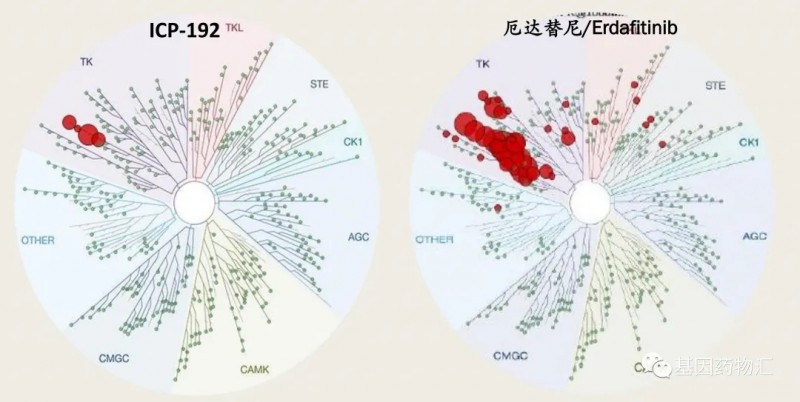
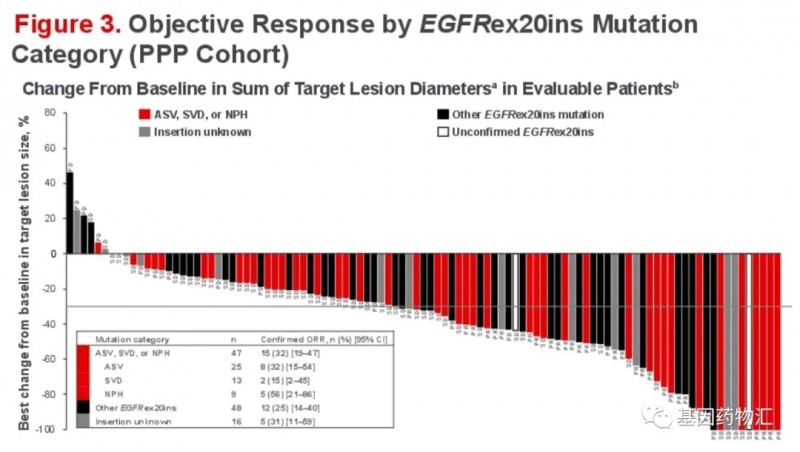
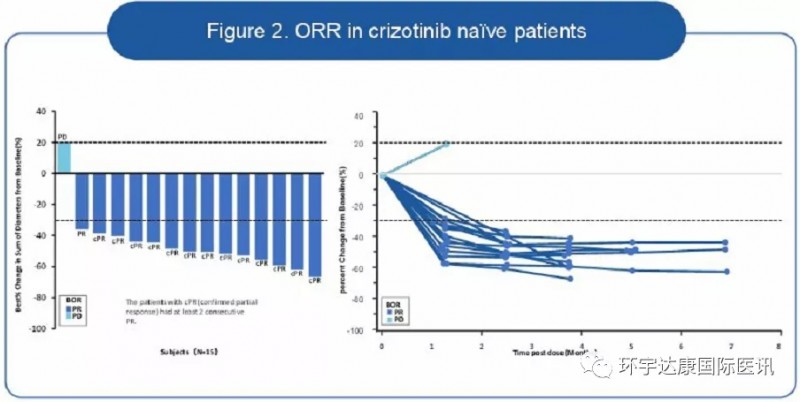
参考资料: 1、https://www.gsk.com/en-gb/media/press-releases/fda-approves-gsk-s-blenrep-belantamab-mafodotin-blmf-for-the-treatment-of-patients-with-relapsed-or-refractory-multiple-myeloma 2、https://endpts.com/fda-approves-gsks-bcma-drug-marking-a-rocky-return-to-cancer-for-the-british-giant/
2020年8月6日,葛兰素史克(GlaxoSmithKline,GSK)宣布其多发性骨髓瘤药物贝兰他单抗莫福汀(belantamabmafodotin)获得FDA的批准上市。2017年,这一药物被FDA批准进行突破性疗法,旨在促进研究药物的开发。尽管这一药物在安全性和功效都还有许多地方有待商榷,不过FDA认为对于患者而言,其收益总体大于风险。这一药物的商业名称为BLENREP,售价为23,900美元/月。
GSK首席科学官兼研发总裁HalBarron博士说:“多发性骨髓瘤是美国第二常见的血液癌,是一种无法治愈的破坏性疾病。BLENREP是首个获得批准的抗BCMA治疗药物,具有改变现行的针对复发或难治性骨髓瘤患者治疗方法的潜力。”
不论是对于多发性骨髓瘤领域还是GSK本身,此次BLENREP的获批都有着举足轻重的地位。对于多发性骨髓瘤领域,这是首个获得FDA批准的抗BCMA蛋白的药物。BCMA是在多发性骨髓瘤细胞中过表达的一种蛋白质,十多年来,研究人员一直在试图靶向这一蛋白。除了BLENREP,目前还有一系列其他BCMA药物也在早期试验中表现良好,有可能在未来几年内问世。
对于GSK来说,这是2014年与诺华交易以来,这家英国巨头自身内部研发出的第一款抗癌药物。GSK在2014年将几乎所有的肿瘤治疗药物交易都转让给了诺华,以换取疫苗和传染病药物的投资组合。在HalBarron领导下的GSK将这一获批视为对外界的一种信号——GSK开始回归抗肿瘤领域了。虽然从不论从医学或是市场角度来看,BLENREP的影响可能有些局限。因为这一药物可能被抗体-药物偶联物的毒性所削弱,而其他晚期抗BCMA药物在最近的试验中显示出了更有利的结果。
GSK表示,关键性试验中的患者寿命比该阶段其他患者的预期寿命长,但FDA在其内部审查中称该公司的生存终点“无法解释”,因为没有对照组。不过,BLENREP用在对包括强生公司的畅销药Darzalex在内的多种药物均无效的患者中,其总体缓解率为31%,FDA就此认为该疗法“可能是有益的”。
不过,这款药物更值得关注的一点在于,它所产生的收益是否能够大于风险?根据临床试验结果,该药物会引起一种称为角膜病变的副作用,使某些患者的视力模糊,甚至导致部分患者“严重的视力丧失”。在参与安全性测试的人群中218例患者中,有77%发生了眼部不良反应,包括角膜病变,视力模糊。在每次给药之前,医生都会通过眼部检查来监测角膜,以便酌情减少或中断剂量。患者还使用了无防腐剂的眼药水。在2.5mg/kg的队列中,因为角膜病变的问题导致停止治疗的患者占2.1%。
业内分析人士普遍认为,对于已经处于最后一线治疗的患者而言,这种风险的出现也并非不可接受,而且,FDA咨询委员会已经以12比0的投票结果建议批准其上市。不过同时他们也认为,处于病情早期阶段的患者不太可能接受这些风险,并且目前临床开发中的其他疗法可能比其更有吸引性。
其他针对BCMA蛋白的疗法包括强生和联想生物技术公司联合开发的CAR-T疗法,以及蓝鸟和百时美施贵宝(BristolMyersSquibb,BMS)开发的“ide-cel”CAR-T疗法。在早期阶段的患者中,其缓解率分别为100%和89%。此外,再生元和安进手中都有BCMA双特异性药物在研,其中再生元的药物在早期试验中已经显示出了较好的结果。
从目前看来,GSK在这款药物上市后将拥有自己在抗癌领域的一方天地,但从长远来看,他们所依靠的市场优势可能极大依赖于三点:其一,BLENREP是第一个进入抗BCMA市场的药物,可以率先抢占一部分市场;其二,与CAR-T疗法相比,抗体在供应上和管理上难度略小;其三,研究人员进一步发掘BLENREP和其他疗法进行组合治疗的方法。GSK肿瘤业务部门负责人AxelHoos在谈及该药时也指出了该药在病人身上的耐受性问题,他认为,尽管这款药物的安全性问题是确实需要引起注意,但医生可以通过滴眼药水和其他药物来治疗。他补充道:“这是抗BCMA的第一个靶向药物,可谓是万众瞩目,我认为这一点就可以为其上市增添许多光辉。”
多发性骨髓瘤研究基金会总裁兼首席执行官PaulGiusti表示:“BLENREP的批准对于复发或难治性多发性骨髓瘤患者而言是一项重要的进步,因为它为目前治疗方法极为有限的的进行性疾病提供了患者急需的新疗法。我们感谢GSK对骨髓瘤患者及其家人作出的坚持不懈的努力。”
BLENREP是2020年以来GSK公司获批的第5个药物,也是2020年以来其获批的第二款抗肿瘤药物。在2020年2月,FDA批准了GSK旗下的Zejura对于新适应症的应用。不过与BLENREP相比,Zejura这一药物是2018年GSK高价于Tesaro手中收购得来,而BLENREP从开发到上市,体内流淌着的都是纯正的GSK的基因,GSK或将于此一步一步回到抗肿瘤药物的赛场。希望在未来,GSK能够乘胜追击,在抗肿瘤领域大放异彩!