食管癌免疫治疗,2021年9月3日派姆单抗联合化疗一线治疗晚期食管或胃食管结合部癌在中国获批上市
2021年9月3日,中国国家药品监督管理局(NMPA)官方网站上刊登另一条最新的批准信息,派姆单抗的新适应症获得了批准,联合化疗一线治疗晚期食管或胃食管结合部癌患者。

这是首个在中国获批的食管癌一线免疫治疗方案。这一方案的获批,标志着我国食管癌患者的治疗,终于迎来了一线免疫时代。
一线治疗:12个月生存率51%
2020年的ESMO虚拟大会上,研究者公开了Ⅲ期KEYNOTE-590试验数据,证实在一线治疗中,派姆单抗+化疗的疗效显著超过了安慰剂+化疗。
接受派姆单抗+化疗治疗的患者,中位总生存期12.4个月,而接受安慰剂+化疗治疗的患者仅为9.8个月。接受派姆单抗+化疗治疗的患者,12个月生存率51%,24个月生存率28%;接受安慰剂+化疗治疗的患者,12个月生存率39%,24个月生存率16%。
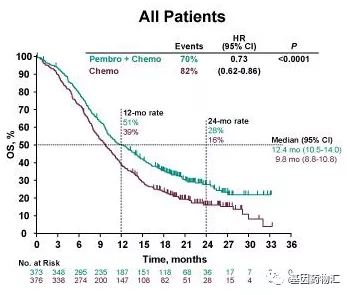
所有患者中位总生存期对比
在无进展生存方面,接受派姆单抗+化疗的患者,中位无进展生存期6.3个月,12个月和18个月无进展生存率分别为25%和16%;接受安慰剂+化疗治疗的患者,中位无进展生存期5.8个月,12个月和18个月无进展生存率分别为12%和6%。
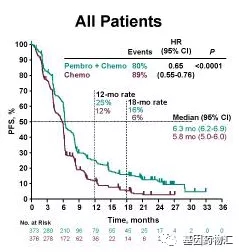
所有患者中位无进展生存期对比
在PD-L1CPS≥10的患者中,派姆单抗+化疗的中位总生存期为13.5个月,中位无进展生存期7.5个月;安慰剂+化疗仅为9.4个月和5.5个月。
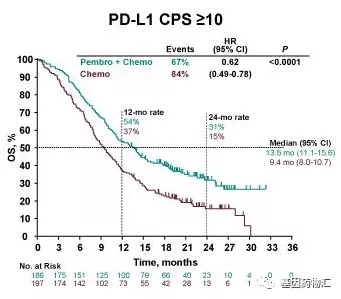
PD-L1CPS≥10患者中位总生存期对比
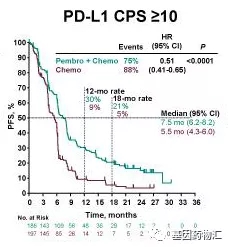
PD-L1CPS≥10患者中位无进展生存期对比
此前2021年3月23日,派姆单抗联合方案一线治疗食管癌的适应症曾经获得FDA的批准。除此以外,派姆单抗二线治疗食管癌的适应症也曾经在世界多个国家获得批准。
@食管癌患者:找不到合适的靶向治疗方案?别慌,来试试免疫治疗吧
食管癌属于消化道肿瘤的一种,其2020年新发癌症患者数量在所有癌症中占第8位,死亡患者数量占第6位,属于恶性程度较高的癌症类型。
与其它癌种相比,获批用于食管癌适应症的靶向治疗药物很少,仅有抗血管生成抑制剂雷莫芦单抗和HER2抑制剂曲妥珠单抗。而目前在研的食管癌靶向治疗药物也较少,很多食管癌患者没能检测出药物需要的靶标,遗憾地与靶向治疗失之交臂。
但随着癌症精准治疗的发展,免疫治疗“异军突起”,多款药物在食管癌的治疗领域取得新进展。同时,也有越来越多免疫药物的临床试验开始招募,为食管癌患者提供了更多选择。
01、纳武单抗:同样联合化疗,冲击一线
2021年4月8日,根据百时美施贵宝的公告,Ⅲ期CheckMate-648试验公开了最新研究数据,使用纳武单抗(Nivolumab,Opdivo,“O药”)方案治疗不可切除的晚期或转移性食管鳞状细胞癌患者,取得了阳性的结果。
根据CheckMate-648试验近期公开的结果,在PD-L1CPS≥5的患者中,纳武单抗+化疗的中位无进展生存期为7.7个月,中位总生存期为14.4个月,均超过了单纯化疗的6.1个月和11.1个月。
研究者同时报告,在CPS≥1的患者中,同样观察到了生存获益。
在同试验设计、亚洲中心并主要纳入亚洲患者的ATTRACTION-4(ONO-4538-37)试验中,尽管总生存期差别不大,但纳武单抗一线治疗方案在无进展生存期方面展现出了明显优势。接受纳武单抗+化疗的患者,中位无进展生存期为10.5个月,超过了仅接受化疗的8.3个月;但两组患者的中位总生存期相似,分别为17.5个月和17.2个月,纳武单抗方案的优势并不显著。
整体来说,纳武单抗方案在消化道肿瘤的治疗中具有不错的潜力,能够有效延长患者的生存期,或在较长时间内有效提升患者生存质量。
02、替雷利珠单抗:二线治疗申请已经获得受理
2021年7月8日,百济神州发布的公告指出,NMPA已经受理了替雷利珠单抗的新适应症,用于治疗曾接受过一线标准化疗后进展或不可耐受的局部晚期或转移性食管鳞癌患者。
该受理基于Ⅲ期RATIonALE302试验的结果。该试验的结构显示,替雷利珠单抗治疗的患者中位总生存期为8.6个月,超过了单纯化疗患者的6.3个月。接受替雷利珠单抗治疗的患者,6个月和12个月生存率分别为62.3%和37.4%,而化疗患者仅为51.8%和23.7%。
其优势在PD-L1表达水平较高的患者中更加显著,中位总生存期为10.3个月vs6.8个月,6个月和12个月生存率分别为67.4%vs50.8%和44.0%vs27.0%。
不过试验中发现,接受替雷利珠单抗治疗的患者中位无进展生存期稍短于化疗。
除此以外,替雷利珠单抗一线治疗食管癌的临床试验正在进行当中,有需求的患者可以咨询医学部,了解试验详情。
03、阿特珠单抗:双免疫方案进军食管癌
相信大家都听说过“双免疫联合疗法”。将两款抑制不同免疫检查点的免疫治疗药物联合使用,凭借其协同作用,进一步提升患者对治疗的响应率,以及疗效和持续时间。
阿特珠单抗(Atezolizumab,Tecentriq)是首款正式获批上市的PD-L1抑制剂,其双免疫联合方案同样受到了广泛的关注。与“O+Y”的双免疫联合“黄金搭档”PD-1+CTLA-4不同,阿特珠单抗选择了一款全新的TIGIT抑制剂Tiragolumab作为“搭档”。
TIGIT是一类在多种免疫细胞(包括T细胞和NK细胞)中表达的受体,通过抑制这一受体,可以增强机体抗肿瘤的反应,并增强PD-1/PD-L1抑制剂的疗效。
目前,阿特珠单抗与Tiragolumab的联合方案已经在多种实体瘤的治疗中取得了阳性的结果,其治疗PD-L1高表达非小细胞肺癌的适应症也已经获得了FDA授予的突破性疗法指定。
这一双免疫联合方案治疗食管癌的临床试验也在进行当中,患者们可以联系医学部了解临床试验详情。、
免疫治疗正逐渐成为"常规",癌症精准治疗新时代到来
免疫疗法被誉为癌症的“第三次革命”,通过调节患者自身免疫系统功能,凭借人体免疫能力来杀伤癌细胞。与其它治疗方案相比,免疫疗法治疗部分癌症的疗效更好、副作用更少,在问世之后迅速地受到了广泛的认可。
国产PD-1抑制剂研究的迅速发展,以及近两年医保目录将大量国产PD-1抑制剂纳入报销范围的改变,都标志着免疫治疗正在逐渐成为癌症患者的治疗“常规”,一个癌症精准治疗新时代即将到来。
从最初的PD-1抑制剂,到后来的PD-L1、CTLA-4抑制剂,再到现在最具特点的“双免疫”联合治疗方案,免疫疗法已经在短短的几年内完成了一个巨大的跨越。我们相信,也许在未来的某一天,当免疫治疗的发展达到了一个新的高度时,免疫治疗能够成为像现在的化疗一样普及的“必需品”,成为全新的癌症治疗“标杆”。
到那时,所有癌症患者的生存期必定会迎来一个巨大的提升。能够真正将癌症变成一种可以凭借长期用药进行控制的“慢性病”的未来,一定会离我们更近。
