非小细胞肺癌第三代EGFR突变靶向药Lazertinib(中文名拉泽替尼、LECLAZA、YH25448)中文说明书
【商品名】LECLAZA
【英文名】Lazertinib
【中文名】拉泽替尼
【别名】YH25448
【生产厂家】韩国柳韩洋行(Yuhan)
【上市情况】美国2020年3月11日获FDA突破性疗法认定;2021年1月18日韩国食品药品管理局(MFDS)批准Lazertinib上市;中国未上市
药品简介
Lazertinib(中文名拉泽替尼、YH25448,商品名LECLAZA)
Lazertinib(YH25448,商品名LECLAZA)是韩国柳韩洋行(Yuhan)研发的第三代EGFR酪氨酸激酶抑制剂,韩国之外的权益已转让给美国强生旗下的杨森制药。2021年1月18日,韩国食品药品管理局(MFDS)批准Lazertinib用于既往接受过EGFR-TKI治疗的EGFRT790M突变阳性局部晚期或转移性非小细胞肺癌患者的治疗。
剂量和给药方法
※推荐剂量
240mg每天一次,空腹或随餐口服,应整片用水送服,不可碾碎、切割、咀嚼或溶解药片。如果漏服,发现时若离次日服药时间12小时以上,可以按量补服,下次服药仍按照原间隔时间。
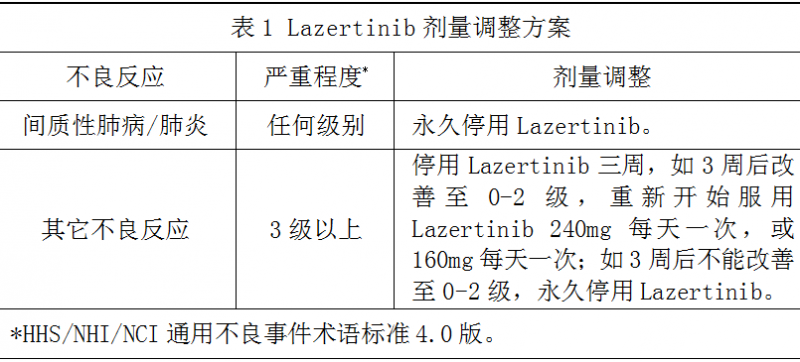
※剂量调整
基于每个患者的安全性和耐受性,可能需要停药和/或降低剂量,剂量调整方案见表1,如果仍无法耐受160mg每天一次,永久停药。
剂型和规格
片剂:80mg。一盒4板,一板21粒,共84粒。
不良反应和注意事项
※间质性肺病/肺炎
1/2期临床试验(YH25448-201)的181例患者中有2例(1.2%)发生间质性肺炎,分别导致给药2.8月和9.8月后永久停药。用药前向患者详细解释该药可能发生的不良反应。如果发现患者出现疑似间质性肺病/肺炎的症状,如呼吸困难、咳嗽和发烧等,立即停药,并及时去医院检查。如果确诊为间质性肺疾病/间质性肺炎,应永久停用Lazertinib,并应进行适当的治疗。
对于有间质性肺病/间质性肺炎危险因素的患者,或患有急性肺部疾病,特发性肺纤维化,间质性肺炎,尘肺,放射性肺炎,药物性肺炎或这些病史的患者,服用Lazertinib前应权衡风险和受益。
※肝毒性
在1/2期临床试验中,分别有13例患者(7.2%)和12例患者(6.6%)观察到丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)升高,均为1-2级。服药前需检查肝功能,服药期间定期复查。如果肝功能出现严重变化,则应采取适当的措施,例如减量或停药。尚未确定Lazertinib在严重肝功能不全患者中的安全性和有效性。
※肾毒性
尚未确定Lazertinib在中度以上肾功能不全患者中的安全性和有效性。
※眼部疾病
在服药期间出现干眼症,流泪,光敏,视力模糊,眼痛和/或眼睛发红等角膜炎体征和症状的患者,应立即咨询眼科医生。
※QTc间期延长
在1/2期临床试验中,有6例(3.3%)患者的QT间期延长,均为1级,其中4名的剂量为240mg每天一次。临床试验中发生的QTc间期延长多数无需治疗即可恢复。Lazertinib与已知可延长QTc间隔的药物合用时,应考虑严密监测心电图。
※心脏毒性
在1/2期临床试验中,没有发现患者发生明显的左室射血分数降低(≧10%),仅发现一例(0.6%)患者发生1级左室射血分数降低。如果患者有心脏疾病史,用药期间,应定期检查心脏功能。
※胚胎-胎儿毒性
动物试验显示,Lazertinib有生殖毒性,没有发现有遗传毒性和致畸性。不建议孕妇服用该药,哺乳母亲在服药期间应停止哺乳。患者和伴侣应在服药期间和停药三月内,使用有效的避孕措施。
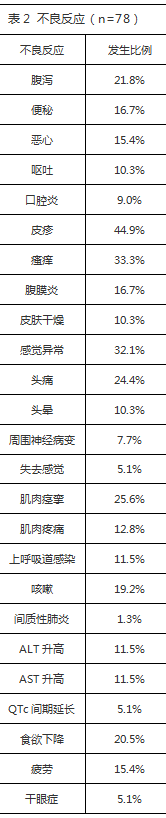
※常见不良反应
在1/2期临床试验中,78例服用Lazertinib240mg每天一次的患者,最常见(≧20%)的不良反应为皮疹(34.6%),瘙痒(33.3%),感觉异常(32.1%),肌肉痉挛(25.6%),头痛(24.4%)和腹泻(21.8%)和食欲下降(20.5%)。3级以上不良反应发生比例为28.2%。12.8%的患者减量,5.1%的患者永久停药。接受240mg剂量的78例患者发生的不良反应具体见表2,大多数为1-2级。
药代动力学
一粒80mg片剂包含96.48mgLazertinib甲磺酸一水合物。Lazertinib是不可逆的EGFR-TKI,体外实验中,对EGFRDel19,L858R和T790M突变高度敏感,并具有强大的血脑屏障穿透能力。
Lazertinib服药2-4小时后达到血药浓度峰值,平均半衰期为64.72小时,15天后达到稳态,22天时的血药浓度蓄积倍数为2-3。在20-320mg剂量范围内,Lazertinib的血浆峰值浓度(Cmax)和浓度-时间曲线下的面积(AUC)接近剂量比例。血浆蛋白结合率99.1-99.7%,表观分布体积4263.97升,在体内广泛分布。
食物和抗酸剂对Lazertinib的生物利用度没有临床意义上的影响。
Lazertinib主要通过GSTM1和CYP3A4代谢。应尽量避免与CYP3A4抑制剂(伊曲康唑,酮康唑,泊沙康唑,伏立康唑,红霉素,特洛霉素,利托那韦,茚地那韦,蛋白水解酶抑制剂,葡萄柚汁,地尔硫卓和维拉帕米等)和CYP3A4诱导剂(苯妥英,卡马西平,利福平,巴比妥酸盐和圣约翰草等)合用。与CYP3A4抑制剂合用时,Lazertinib的血药浓度会升高;与CYP3A4诱导剂合用时,Lazertinib的血药浓度会降低。
Lazertinib是CYP3A4和BCRP抑制剂,是P-gp和CYP3A4的底物。
应尽量避免与BCRP底物(瑞舒伐他汀,甲氨蝶呤,柳氮磺吡啶,氟伐他汀和阿托伐他汀等)和CYP3A4底物(咪达唑仑,阿普唑仑,洛伐他汀,辛伐他汀,二吡酰胺,决奈达隆,贝普地尔和非洛地平等)合用。
临床疗效
1/2期临床试验(YH25448-201)中,截止日期2019年9月30日,162例T790M阳性NSCLC患者(所有剂量),客观有效率59%,中位无进展生存期10.9月。其中240mg剂量水平的78例患者,客观有效率58%,中位无进展生存期11.0月。
22例脑转移患者,颅内客观有效率55%,中位无进展生存期未达到。以上数据均为第三方独立评估。
储存
于室温(1℃-30℃)下密闭保存,避免受潮。
注:该药物并未在中国上市,有相关需求的读者可以联系在线客服,咨询有没有合适的临床试验
