胃癌新药,获批上市的胃癌HER2阳性靶向治疗方案和胃癌HER2阳性靶向药物研发最新进展有哪些
HER2是胃癌第一个也是最重要的一个靶点,在胃癌当中的表达率大概是在15%左右。目前晚期胃癌HER2治疗已获得全球共识,NCCN指南推荐胃癌患者检测HER2表达,如果检测结果显示HER2+,那么患者一线推荐使用曲妥珠单抗联合化疗。
HER2阳性胃癌获批的治疗方案
目前,HER2阳性胃癌获批的靶向治疗方案共有4种。
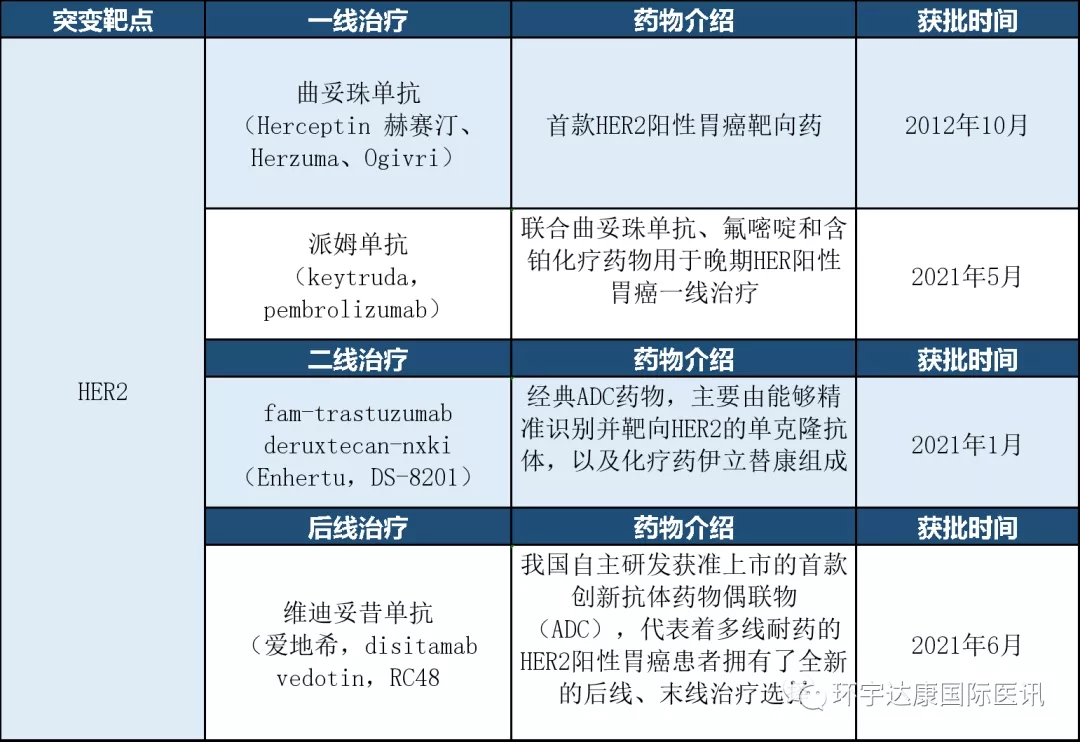
此外,多项抗HER2药物以及联合免疫治疗的临床研究正在进行中。
HER2阳性胃癌新药研发进展
01、一线治疗胃癌缓解率达53%!玛格妥昔单抗+PD-1疗效显著
2021年9月16日,MacroGenics公司公布了其HER2单抗Margenza(margetuximab-cmkb,玛格妥昔单抗)与抗PD-1抗体联用,一线治疗HER2阳性,PD-L1阳性的胃食管腺癌(GEA)患者的临床结果。
截至2021年7月19日,在40名可以评估疗效的患者中,21名获得缓解(53%,95%CI,36%-69%)。在接受过至少一次病灶扫描的41名患者中,32名患者的肿瘤缩小(78%)。
患者的疾病控制率为73%,中位缓解持续时间为10.3个月,中位无进展生存期为6.4个月。在12和18个月时,总生存率为85%。
Margenza与曲妥珠单抗同为靶向HER2的单克隆抗体药物。单克隆抗体的结构分为抗原结合片段(Fab)和结晶片段(FC)两部分,Margenza对FC部分的结构进行了进一步的优化,因此可以取得更好的疗效。
目前,Margenza已经获得批准治疗HER2阳性乳腺癌患者。研发公司MacroGenics正与再鼎医药合作,计划将Margenza的临床试验推广至中国及其它华人地区。
02、客观缓解率75%!双特异性抗体ZW25一线治疗HER2+胃癌疗效强劲!
Zanidatamab(泽尼达妥单抗,代号为ZW25)是一种基于Zymeworks的AzymetricTM平台的双特异性抗体,其可以同时结合HER2的两个非重叠表位,称为双互补位结合,可以双重阻断HER2信号,增加HER2蛋白从细胞表面的结合和去除,具有更强的抗HER2驱动肿瘤生长的作用。
这样一个新型双特异性抗体,跨癌肿有效,副作用轻微,令学术界十分激动。
2021年ESMO大会上,Zanidatamab2期临床试验公布了一线治疗HER2阳性胃食管腺癌(GEA)卓越数据!
对36名表达HER2的GEA患者接受了扎尼达他单抗联合CAPOX(卡培他滨/奥沙利铂;n=14)、FP(5FU/顺铂;n=2),或mFOLFOX6(5FU/亚叶酸/奥沙利铂;n=20)治疗,没有患者之前接受过HER2靶向治疗。在28名可评估的患者中:
●已确认的总体客观缓解率(cORR)为75%,疾病控制率(DCR)为89%;
●扎尼达他单抗+CAPOX/FP组的疾病控制率高达100%;
●中位缓解持续时间(mDOR)为16.4个月,中位无进展生存期(mPFS)为12个月;
●除一名患者外,所有患者的肿瘤大小均有所减少,在数据截止时,61%的患者仍在接受治疗!
●数据支持泽尼达妥单抗+化疗作为一线HER2阳性GEA潜在新护理标准的基础
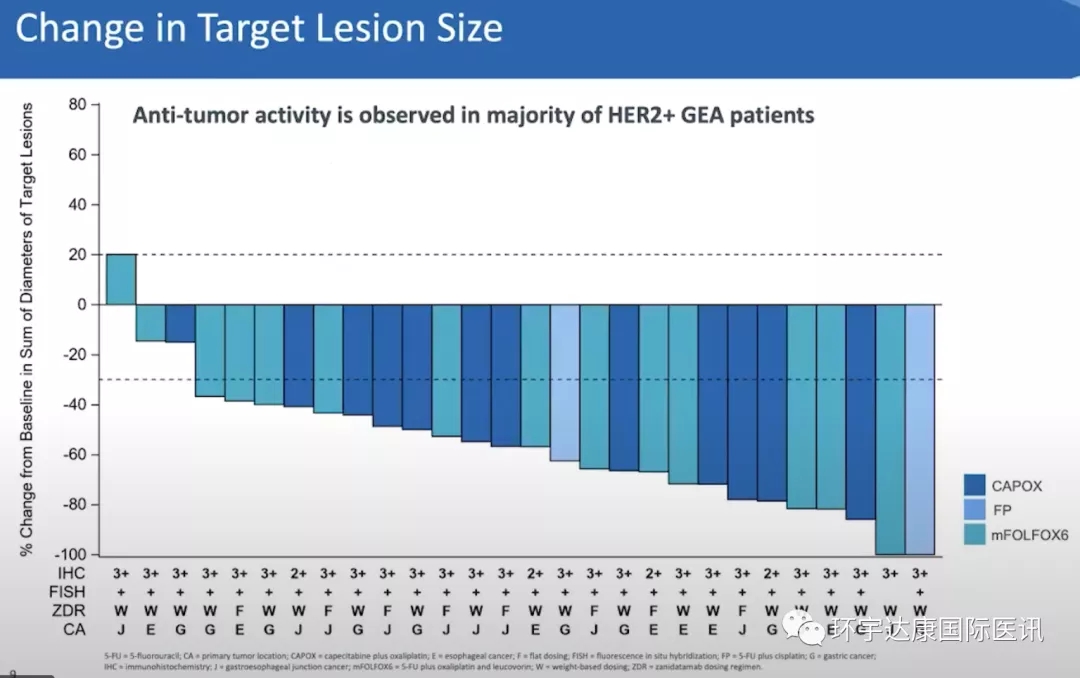
Zanidatamab与不同化疗联用,在28名患者中导致27名患者肿瘤缩小(图片来源:Zymeworks官网)
03、KN026联合KN046全新方案获FDA孤儿药称号
2020年12月23日,由我国制药公司康宁杰瑞自主研发的双特异性抗体KN026(抗HER2双特异性抗体)与KN046(PD-L1/CTLA-4双特异性单域抗体)联合疗法获美国食品药品监督管理局(FDA)授予孤儿药资格(OrphanDrugDesignation,ODD),用于治疗HER2-阳性或HER2-低表达胃癌及胃食管连接部癌(GC/GEJ)。
早期研究显示,KN046联合KN026在HER2阳性实体瘤中的客观缓解率为64.3%(9/14),疾病控制率高达92.9%(13/14),该结果已在今年SITC发布。
04、全新抗体欧联药物ARX788已获FDA孤儿药称号
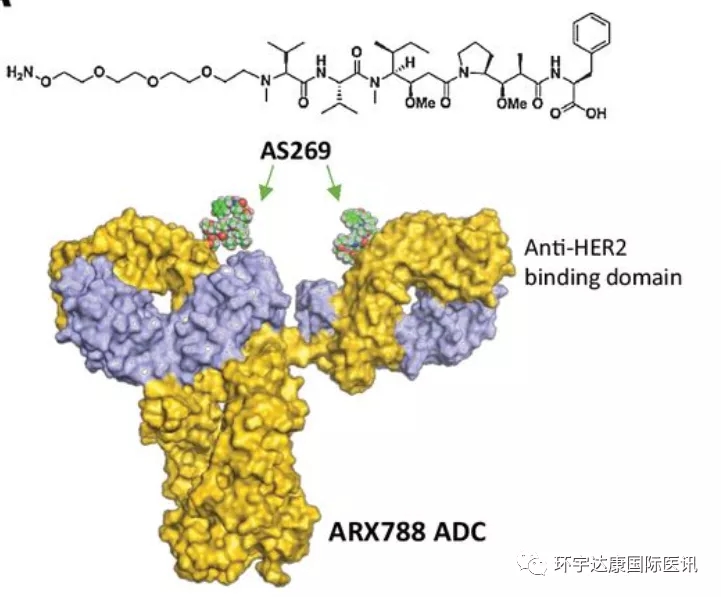
ARX788是浙江医药旗下新码生物与美国Ambrx合作研发的新一代靶向HER2的ADC,用于治疗乳腺癌、胃癌等HER2阳性实体瘤。ARX788是一种强效且高度稳定的抗体药物偶联物(ADC),与T-DM1作用机制类似,ARX788是由抗HER2单克隆抗体赫赛汀和细胞毒性小分子药物AS269组成的抗体偶联药物,抗HER2单克隆抗体可与人HER2特异性结合,AS269为高效微管抑制剂,可抑制细胞生长。
2021年3月18日,安博生物(Ambrx)宣布其新药ARX788获得FDA授予孤儿药资格,用于治疗HER2阳性胃癌和胃食道结合部癌;2021年1月,FDA授予全新抗体偶联药物ARX788快速通道指定,用于治疗HER2阳性乳腺癌。
根据最新的临床实验数据显示,截止2021年06月30日,共入组30例HER2阳性晚期胃癌/胃食管连接部腺癌患者。其中90%的患者既往接受过曲妥珠单抗。
结果显示:在可评估的27例患者中,12例(12/27,44.4%)受试者最佳疗效为部分缓解(PR),4例(4/27,14.8%)为疾病稳定(SD),总的客观缓解率(ORR)为44.4%,疾病控制率为(DCR)59.3%。其中1.7mg/kgQ3W剂量组的ORR为42.9%,DCR达到了85.7%。ARX788安全性和耐受性良好。
好消息是,由国内几家知名的癌症医院牵头,中国近期开展了ARX788新药的临床试验,并且已经开始正式招募患者。想参加的患者可以联系全球肿瘤医生网医学部进行评估申请。
未完待续!期待更多新药开花结果
在精准医学的时代背景下,新的药物、新的治疗方案仍在路上。伴随着新药的不断研发和转化研究的不断深入,相信在不久的将来,HER2阳性胃癌患者全程治疗的药物布局和临床结局将有重大改变。
“方舟援助计划”“由全球肿瘤医生网联合无癌家园、权威基因检测机构、国际药厂、知名肿瘤中心发起的针对癌症基因突变肿瘤患者的活动。本计划旨在降低肿瘤患者基因检测费用,为患者提供上市新药和未上市新药免费治疗的机会。参加“方舟援助计划”!为肿瘤患者持续提供抗癌药物带来的生存希望!
想参加的病友可以将基因检测报告,诊断报告电子版或拍照发送至doctor.huang@globecancer.com,邮件中留下联系方式,医学部收到报告分析完毕后一个工作日内电话联系或直接致电全球肿瘤医生网医学部评估。
国际知名胃癌专家

JeffreyMeyerhardt
丹娜法伯癌症研究院

MilindJavle
MD安德森癌症中心

KimmieNg
丹娜法伯癌症研究院

ThomasA.Abrams
丹娜法伯癌症研究院
