第二代泛TRK抑制剂Zurletrectinib(ICP-723)疾病控制率高达100%
100%接受治疗的晚期患者肿瘤控制稳定,超过60%患者肿瘤显著缩小甚至消失,国研新一代“不限癌种”靶向药成为NTRK阳性肿瘤患者抗癌新希望!
在抗癌的道路上,科学家们从未停止过探索的脚步。近两年,研究人员发现首个不区分癌种的可用药基因--NTRK,一种导致多种成人和儿童恶性癌症发生的致癌基因,成为全球最火的抗癌靶点之一。针对这一靶点已上市的两款靶向药物拉罗替尼和恩曲替尼因临床数据卓越,每年可以帮助成千上万的人,很多NTRK融合癌症患者接受治疗后重新回到了正常生活,这两款药物也在国内病友们的期待中在中国获批上市。
值得中国病友们振奋的是,各大药企已纷纷开展针对这一靶点的新药研发。近期,InnoCarePharma公司自主研发的第二代泛TRK抑制剂ICP-723公布了最新的临床数据,展现出卓越的潜力。
疾病控制率高达100%!国研新一代"不限癌种"靶向药ICP-723宣战NTRK实体瘤
ICP-723(Zurletrectinib)是我国自主研发的口服、高选择性的新一代泛TRK抑制剂,可以治疗携带NTRK融合基因的晚期或转移性实体瘤,包括乳腺癌、结直肠癌、肺癌、甲状腺癌等,以及对第一代NTRK抑制剂拉罗替尼和恩曲替尼耐药的患者。
2021年8月31日InnoCarePharma公司宣布其第二代泛TRK抑制剂ICP-723获得美国食品药品监督管理局(FDA)的研究性新药批准在美国开始I期临床试验。在2022年的ASCO大会上,我们首次看到了这款国研药物的初步临床数据,非常振奋人心!多名接受治疗的患者不仅病情得到了稳定,甚至出现了肿瘤明显缩小的喜人情况。

在这项I期剂量递增研究中,截止到2022年2月11日,共有17名患者接受ICP-723治疗,剂量为1mgQD至8mgQD,其中6名为NTRK融合阳性的患者。
结果显示:6例NTRK融合患者中,总客观缓解率(ORR,靶病灶缩小30%以上)为66.7%(4例),疾病控制率(DCR)高达100%,这意味着6例NTRK融合阳性的患者在接受ICP-723治疗后,病情都得到了有效控制,病灶稳定或显著缩小。
值得一提的是,1名脑转移的患者也达到了部分缓解,脑部靶病灶从10毫米缩小到3毫米。
所有获得部分缓解的患者在4周治疗后的第一次肿瘤评估时均对ICP-723做出反应,并且所有达到部分缓解的患者在数据截止时仍持续响应。
根据上述初步研究数据表明,ICP-723在晚期实体瘤患者中安全且耐受性良好。各种癌症类型的NTRK基因融合的患者出现了得到了令人鼓舞的临床疗效,包括入脑活性。
此外,2022年10月,首位青少年患者已接受临床实验给药,这是ICP-723在成人患者中表现出良好的安全性和有效性后,首次在青少年(12至18岁)患者的临床研究中进行评估,结果非常振奋人心。
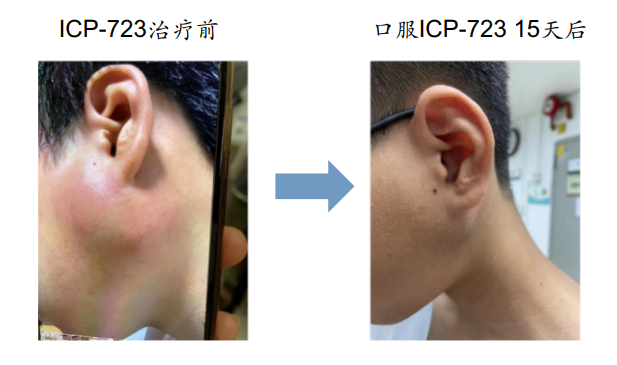
这名12岁的花季少年因为左耳垂下肿胀1年去医院进行检查,结果确诊为涎腺源性肿瘤,并且因为肿瘤巨大(52*41*62mm),差不多和橙子一样,累及左侧下颌骨,无法手术,于是在2022-10-24入组新一代NTRK抑制剂ICP-723在实体肿瘤患者中的安全性、耐受性、药代动力学的多中心、非随机、开放性Ⅰ/Ⅱ期临床试验。2022-10-25开始接受ICP-723治疗后,奇迹出现,仅3天,肿瘤显著缩小,15天后的照片对比能看到肿瘤持续消退。截至2023年7月,肿瘤已经缩小一半以上(20*14*25mm),并且仍在持续治疗中。
2024年初,zurletrectinib(ICP-723)在中山大学肿瘤防治中心完成首例儿童患者给药,这也是zurletrectinib在成人和青少年(12周岁到18周岁)患者中显示良好安全性和有效性后,首次在儿童患者(2周岁到12周岁)中启动临床研究。
这意味着,无论年龄大小,无论肿瘤部位,无论什么类型的恶性癌症,只要存在特定的NTRK融合基因,就有机会参加ICP-723在国内开展的临床,接受新药治疗。
喜讯!ICP-723临床研究启动,国内多家癌症中心招募成人及儿童患者
值得振奋的是,目前在中国,ICP-723的临床试验目前正在招募患者,已经有大量NTRK阳性的患者通过全球肿瘤医生网成功入组。
招募信息
药品名称:ICP-723(Zurletrectinib)
作用靶点:NTRK
研发公司:InnoCarePharma公司
适应症:NTRK融合阳性实体瘤(成人及儿童)
招募信息(部分):
1.经组织病理学证实手术不可切除的局部晚期或者转移性实体瘤或原发性中枢神经系统肿瘤,已知的治疗方式无效或复发的;标准治疗下仍发生进展、不耐受标准治疗或不存在标准治疗的患者;
2.经指定的中心实验室检测到携带NTRK基因融合;
3.既往未接受过其他TRK抑制剂规范治疗
注:做了基因检测的病友可以拿出报告看看,一旦存在NTRK融合,可以马上联系医学部看看是否有机会接受国内新药治疗,看不懂的病友也可以致电全球肿瘤医生网医学部解读报告。
总之,Zurletrectinib作为一款新型、高效的抗癌药物,为NTRK融合阳性肿瘤患者带来了新的治疗选择。在某些罕见的肿瘤类型,如先天性婴儿纤维肉瘤等,NTRK基因融合发生率高达90%。NTRK基因融合与至少19种成人和儿童的肿瘤类型相关,包括肺癌、结直肠癌、乳腺癌、胰腺癌和黑色素瘤等。
Zurletrectinib的出现,不仅为这些患者带来了希望之光,也让我们看到了人类在抗癌道路上的不断进步和突破。Zurletrectinib正在中国推进注册临床试验,预计今年下半年提交新药上市申请。8毫克及以上剂量组,不同实体瘤NTRK基因融合阳性患者中,总缓解率(ORR)高达80-90%。让我们共同期待ICP-723在未来能够带来更多的惊喜和突破,为更多肿瘤患者带来治愈的可能。
参考文献:
https://mp.weixin.qq.com/s/nG75pxjaDBALB2F7jn5EyA
https://ascopubs.org/doi/10.1200/JCO.2022.40.16_suppl.3106
