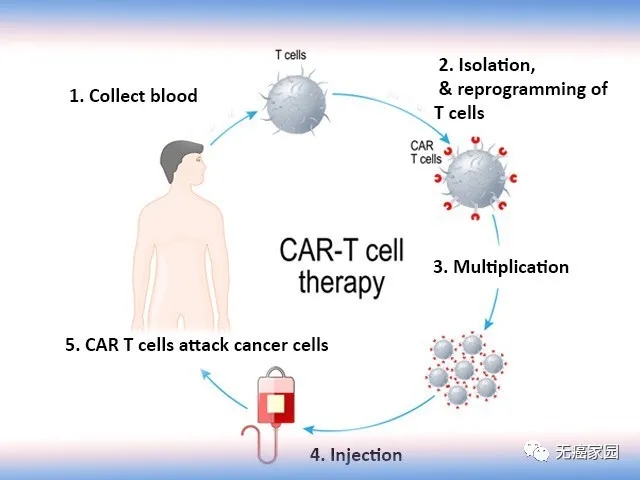
今日,罗氏集团成员基因泰克宣布美国FDA已经批准Avastin用于治疗接受治疗后进展的胶质母细胞瘤成人患者。该药物之前获得了FDA加速批准程序的临时批准,于今日获得完全批准。

神经胶质瘤是最常见的恶性原发性脑瘤,占所有原发性脑瘤的近四分之一,占所有恶性肿瘤的四分之三。胶质母细胞瘤是最常见和最具侵袭性的胶质瘤类型,占所有胶质瘤的一半以上。预计2017年美国将有超过1.23万人被诊断为胶质母细胞瘤。这一群体还有巨大的医疗需求未被满足。
基因泰克带来的Avastin是一种生物抗体,可以特异性结合血管内皮生长因子,它在整个肿瘤生命周期中发挥着重要作用,帮助肿瘤发展、维持血管生成。Avastin可以通过直接结合VEGF蛋白,来阻止它与血管细胞上的受体相互作用,从而干扰肿瘤的血液供应。肿瘤血液供应被认为是肿瘤在体内生长和扩散的能力的关键。它已经获批用于多种肿瘤类型,包括转移性结直肠癌、晚期非鳞状非小细胞肺癌、转移性肾癌、晚期宫颈癌、复发型卵巢癌等。此次获批用于胶质母细胞瘤成人患者,也为这一患者群体提供了新的治疗选择。

Avastin获得完全批准是基于它在胶质母细胞瘤中的所有证据,包括一项来自3期临床试验EORTC26101的数据。该试验是由欧洲癌症研究与治疗组织进行的一项独立的多中心、随机、开放标签的3期试验,该研究评估了Avastin加洛莫司汀化疗在432名曾接受过胶质母细胞瘤治疗的患者中的疗效。研究的主要终点是总生存期和研究者评估的无进展生存期是关键次要终点。结果显示,
基于Avastin的治疗没有显著增加OS(HR=0.91,p=0.4578)。由于主要终点没有达到,所有次要终点应被视为描述性的
与单独化疗相比,基于Avastin的治疗延长了无疾病进展或死亡的时间(中位PFS:4.2个月vs.1.5个月,HR=0.52,95%CI:0.41-0.64)
在基线时服用皮质类固醇的患者中,Avastin组比对照组有更多患者在治疗期间能够完全停用皮质类固醇
在Avastin组中,有22%的人因为不良反应停止治疗,而在对照组中有10%的人出现不良反应
不良事件与之前在Avastin批准的适应症的试验中所见一致
“胶质母细胞瘤是脑瘤中最常见和最具侵袭性的形式,可能很难治疗,”罗氏首席医学官兼全球产品开发负责人SandraHorning博士表示:“在治疗过程中延缓疾病进展并减少皮质类固醇的需求,被认为是那些受到这种破坏性疾病影响的患者的重要目标,他们的治疗方案有限。”
参考资料:
[1]FDAGrantsGenentech'sAvastinFullApprovalforMostAggressiveFormofBrainCancer
[2]Genentech官方网站