基于T细胞的癌症免疫疗法在近年来可谓大显神通。然而,该疗法至今几乎对实体瘤却难以招架。这其中的一个主要原因就在于实体瘤高度免疫抑制性的微环境,让抗肿瘤的T细胞活性大打折扣。
最近,罗彻斯特大学(UniversityofRochester)的科学家们在《自然》子刊《NatureCommunications》上发表文章,报道了一种能够克服上述困难,让过继性T细胞疗法在小鼠黑色素瘤模型中产生显著疗效的方法——光照!

▲文章通讯作者MinsooKim教授
光照是如何增强一个T细胞的抗肿瘤活性的呢?这还要从实体瘤免疫抑制性微环境的产生机制说起。
调节性T细胞是造成免疫抑制性肿瘤微环境的重要因素。在科学家使用的小鼠模型中,被通过皮下注射癌细胞而在耳部形成的黑色素瘤微环境中,就有着大量处于终端活化状态的Treg,且占了所有Treg的绝大多数。体外实验显示,活化的Treg能显著抑制CD8阳性T细胞的抗肿瘤活性,使其可杀伤癌细胞的颗粒酶释放水平大大下降。
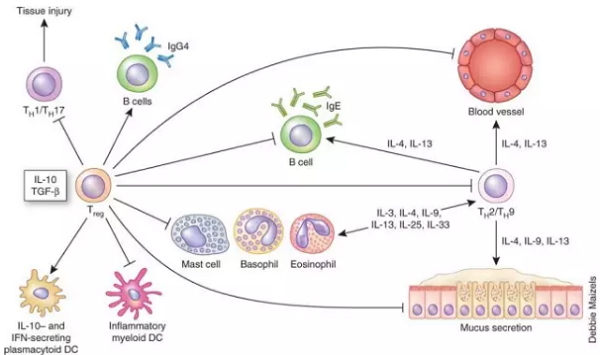
▲Treg的免疫抑制作用(图片来源:《NatureMedicine》)
CD8阳性T细胞的颗粒酶释放是由Ca2+介导的。在T细胞受体活化后,T细胞内的磷脂酶PLCγ被激活,并将PIP2水解生成IP3。IP3会结合到T细胞内质网膜上的IP3受体Ca2+通道,使其开放,让内质网内储存的Ca2+释放到细胞质中,进而激活细胞膜上的钙释放激活钙通道,让T细胞外的Ca2+大量内流,最终启动颗粒酶的胞吐过程。Treg被发现不仅能抑制T细胞的IP3生成,还能通过TGFβ抑制Ca2+内流,以此共同削弱CD8阳性T细胞的活性。
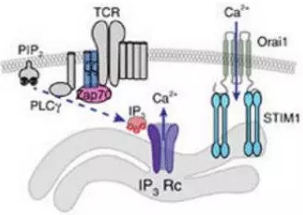
▲T细胞中的Ca2+信号通路(图片来源:《NatureCommunications》)
因此,提高效应T细胞内的钙离子浓度或可增强其抗肿瘤的活性。然而试验显示,施加非选择性的钙离子载体ionomycin并不能起到理想的效果,反而可能抑制T细胞活性,这很可能是由于ionomycin同时激发了Treg等免疫抑制性细胞所致。
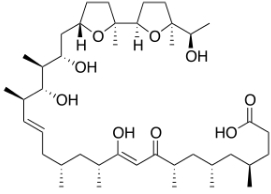
▲Ionomycin分子结构
为了专一性地激活病灶处的抗肿瘤T细胞,科学家们想到了一种源自绿藻的光敏感性离子通道channelrhodopsin。他们选取了比channelrhodopsin光敏感度高出近70倍的变异体CatCh,将其表达于待移植的治疗性细胞毒T细胞,使其在人为可控的光刺激下可迅速激发Ca2+内流,并直接摆脱了Ca2+内流过程对IP3生成和内质网Ca2+储备的依赖,进而得以有效地克服Treg的免疫抑制作用。
在小鼠黑色素瘤模型的实验中,研究人员只需要以LED光源直接照射小鼠的耳部,便可有力地增强此处的细胞毒T细胞活性,包括颗粒酶和干扰素γ的释放,并引起全身性的抗肿瘤免疫应答,最终有效地实现了肿瘤消退。实验数据还显示,上述方法可帮助T细胞同时克服Treg和另一种主要的免疫抑制性细胞MDSC对其抗肿瘤免疫应答的负面影响。

▲LED光源照射小鼠肿瘤病灶(图片来源:《NatureCommunications》)
“我们方法的妙处就在于其如此的灵活性和非毒性,可专注于激发T细胞,让后者去做它们应该去做的事,”文章通讯作者MinsooKim教授说道。